Sejarah silikon, sifat, struktur, mendapatkan, menggunakan

- 4817
- 900
- Julius Dibbert
Dia silikon Ia adalah elemen bukan logam dan pada masa yang sama metalloid yang diwakili oleh simbol kimia jika. Ia adalah semikonduktor, yang merupakan bahagian penting dari komputer, kalkulator, telefon bimbit, sel solar, diod, dll.; Ini adalah komponen utama yang membolehkan penyelesaian era digital.
Silikon selalu ada di kuarza dan silikat, kedua -dua mineral yang mengarang sekitar 28% dalam jisim seluruh kerak bumi. Oleh itu, unsur kedua yang paling banyak di permukaan bumi, dan keluasan padang pasir dan pantai menawarkan perspektif betapa banyaknya.
 Gurun adalah sumber semulajadi zarah silika atau granit yang banyak dengan mineral lain. Sumber: Pxhere.
Gurun adalah sumber semulajadi zarah silika atau granit yang banyak dengan mineral lain. Sumber: Pxhere. Silikon tergolong dalam kumpulan 14 jadual berkala, sama seperti karbon, yang terletak di bawah ini. Itulah sebabnya elemen ini dianggap sebagai metalloid tetravalen; Ia mempunyai empat elektron Valencia dan dalam teori anda boleh kehilangan mereka semua untuk membentuk kation jika4+.
Harta yang berkongsi dengan arang batu adalah keupayaannya untuk menyatukan; iaitu, atom mereka dikaitkan secara kovalen untuk menentukan rantai molekul. Begitu juga, silikon boleh membentuk "hidrokarbon" sendiri, yang dipanggil siltan.
Sebatian silikon yang utama adalah silikat yang terkenal. Dalam bentuk murni ia boleh berlaku sebagai monocrystalline pepejal, polyristaline atau amorfus. Ia adalah pepejal yang agak tidak aktif, jadi ia tidak mewakili risiko yang besar.
[TOC]
Sejarah
Batu silikon
Silikon mungkin salah satu elemen yang mempunyai pengaruh yang paling kepada sejarah manusia.
Unsur ini adalah protagonis zaman batu, dan juga era digital. Asal -usul mereka bermula ketika tamadun bekerja dengan kuarza dan membuat kaca mereka sendiri; Dan pada masa ini, ia adalah komponen utama komputer, komputer riba dan telefon pintar.
Praktikal silikon telah menjadi batu dari dua era yang jelas ditakrifkan dalam sejarah kita.
Pengasingan
Apabila silika begitu banyak, nama yang dilahirkan dari batu api, ia harus mengandungi unsur yang sangat kaya di kerak bumi; Ini adalah kecurigaan yang berjaya terhadap Antoine Lavoisier, yang pada tahun 1787 gagal dalam percubaannya untuk mengurangkannya dari oksidanya.
Beberapa waktu kemudian, pada tahun 1808 Humphry Davy membuat percubaannya sendiri dan memberikan nama pertamanya kepada elemen: 'Silicium', yang diterjemahkan akan menjadi seperti 'Pedernal Metal'. Iaitu, silikon pada masa itu dianggap sebagai logam kerana kekurangan penciriannya.
Kemudian, pada tahun 1811 ahli kimia Perancis Joseph l. Gay-Lussac dan Louis Jacques Thénard berjaya menyediakan silikon amorf untuk kali pertama. Untuk ini mereka bertindak balas silikon tetrafluoride dengan kalium logam. Walau bagaimanapun, mereka tidak membersihkan atau mencirikan produk yang diperoleh, jadi mereka tidak menyimpulkan bahawa ia adalah elemen silicium baru.
Ia tidak lain tetapi pada tahun 1823 ketika ahli kimia Sweden Jacob Berzelius memperoleh silikon amorf dengan kesucian yang mencukupi untuk mengenalinya sebagai silikon; Nama yang diberikan pada tahun 1817 oleh ahli kimia Scotland Thomas Thomson ketika mempertimbangkannya sebagai elemen bukan logam. Berzelius melakukan tindak balas antara kalium dan kalium fluorosilicate untuk menghasilkan silikon ini.
Silikon kristal
Silikon kristal disediakan untuk pertama kalinya pada tahun 1854 oleh ahli kimia Perancis Henry DeVille. Untuk mencapai matlamat ini, Deville membuat elektrolisis campuran aluminium dan natrium klorida, dengan itu mendapatkan kristal silikon yang diliputi oleh lapisan aluminium silikoro, yang dihapuskan (nampaknya) mencuci mereka dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air dengan air.
Sifat fizikal dan kimia
Penampilan fizikal
 Silikon asas, yang mempunyai kilauan logam, tetapi sebenarnya metalloid. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]
Silikon asas, yang mempunyai kilauan logam, tetapi sebenarnya metalloid. Sumber: Hi-Res Imej Elemen Kimia [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)] Silikon dalam bentuk murni atau asasnya terdiri daripada pepejal abu -abu atau hitam kebiruan (imej unggul), yang walaupun ia bukan logam, membentangkan wajah cerah seolah -olah ia sebenarnya.
Ia adalah pepejal yang keras tetapi rapuh, yang juga mempamerkan permukaan squamous jika dibentuk oleh polyristales. Sebaliknya, silikon amorf kelihatan seperti pepejal serbuk coklat gelap. Terima kasih kepada ini, mudah untuk mengenal pasti dan membezakan satu jenis silikon (kristal atau polyristaline) dari yang lain (amorf).
Jisim molar
28.085 g/mol
Nombor atom (z)
14 (14Yeah)
Takat lebur
1414 ºC
Takat didih
3265 ºC
Ketumpatan
-Pada suhu bilik: 2.33 g/ml
-Betul -betul di titik lebur: 2.57 g/ml
Perhatikan bahawa silikon cecair lebih padat daripada silikon pepejal; yang bermaksud bahawa kristal mereka akan terapung pada fasa cair, seperti sistem air ais. Penjelasan adalah disebabkan oleh fakta bahawa ruang interatomi antara atom jika dalam gelasnya lebih besar (kurang padat), daripada yang sepadan dalam cecair (padat).
Haba Fusion
50.21 kJ/mol
Haba pengewapan
383 kJ/mol
Kapasiti haba molar
19,789 j/(mol · k)
Elektronegativiti
1.90 pada skala Pauling
Tenaga pengionan
-Pertama: 786.5 kJ/mol
-Kedua: 1577.1 kJ/mol
-Ketiga: 3231.6 kJ/mol
Radio atom
111 petang (diukur dalam kristal berlian masing -masing)
Kekonduksian terma
149 w/(m · k)
Resistiviti elektrik
2.3 · 103 Ω · m hingga 20 ºC
Kekerasan mohs
6.5
Bersekutu
Atom silikon mempunyai keupayaan untuk membentuk pautan Si-Si yang mudah, yang akhirnya menentukan rantai (si-si-si-...).
Harta ini juga ditunjukkan oleh karbon dan sulfur; Walau bagaimanapun, hibridisasi SP3 silikon lebih kekurangan berbanding dengan dua elemen yang lain dan, sebagai tambahan, orbital 3p mereka lebih meresap, jadi pertindihan orbitals SP3 Hasilnya lebih lemah.
Boleh melayani anda: reaksi eksotermik dan endotermikPurata tenaga ikatan kovalen Si-Si dan C-C adalah 226 kJ/mol dan 356 kJ/mol, masing-masing. Oleh itu, pautan SI-jika lebih lemah. Kerana ini, silikon bukanlah asas kehidupan (atau sulfur). Malah, rantai terpanjang atau kerangka yang boleh dibentuk silikon biasanya empat ahli (jika4).
Nombor pengoksidaan
Silikon boleh mempunyai mana -mana nombor pengoksidaan berikut, dengan mengandaikan setiap mereka kewujudan ion dengan beban masing -masing: -4 (ya4-), -3 (ya3-), -2 (ya2-), -1 (ya-), +1 (ya+), +2 (ya2+), +3 (ya3+) dan +4 (ya4+). Dari semuanya, -4 dan +4 adalah yang paling penting.
Contohnya, -4 diandaikan dalam silikon (mg2Ya atau mg22+Yeah4-); Walaupun +4 sepadan dengan silika (SIO2 atau jika4+Sama ada22-).
Reaktiviti
Silikon tidak larut dalam air, serta asid atau pangkalan yang kuat. Walau bagaimanapun, ia larut dalam campuran asid nitrik dan fluorhorhorical pekat (HNO3-Hf). Begitu juga, ia larut dalam larutan alkali panas, tindak balas kimia berikut yang berlaku:
Ya (s) + 2NAOH (ac) + h2Atau (l) => na2SIO3(Ac) + 2h2(g)
Natrium metasilicate, na2SIO3, Ia juga terbentuk apabila silikon larut dalam natrium karbonat cair:
Ya (s) + na2Co3(L) => na2SIO3(L) + c (s)
Pada suhu bilik ia tidak bertindak balas sama sekali dengan oksigen, bahkan pada 900 ° C, apabila lapisan vitreous pelindung SIIO mula terbentuk2; Dan kemudian, pada 1400 ° C, silikon bertindak balas dengan nitrogen udara untuk membentuk campuran nitrhures, tanpa dan jika3N4.
Silicon juga bertindak balas pada suhu tinggi dengan logam untuk membentuk silikat logam:
2mg (s) + ya (s) => mg2Ya (s)
2cu (s) + ya (s) => cu2Ya (s)
Pada suhu bilik, ia bertindak balas letupan dan langsung dengan halogen (tidak ada lapisan SIO2 yang melindunginya dari ini). Contohnya, anda mempunyai reaksi pembentukan SIF4:
Ya (s) + 2f2(g) => sif4(g)
Dan walaupun silikon tidak larut di dalam air, Red Alive bertindak balas dengan arus stim:
Ya (s) + h2Atau (g) => Si2(s) + 2h2(g)
Struktur dan konfigurasi elektronik
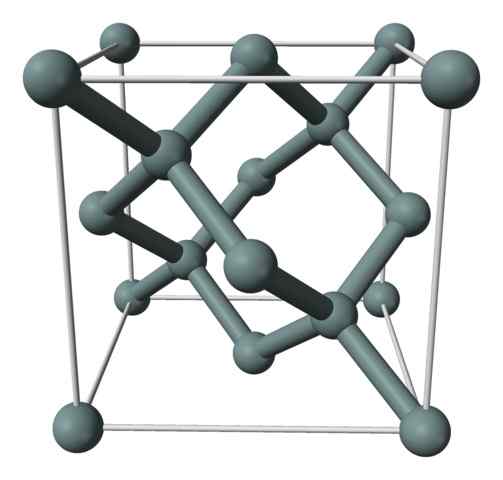 Struktur kristal atau sel kesatuan silikon yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 [domain awam]
Struktur kristal atau sel kesatuan silikon yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 [domain awam] Imej atas menunjukkan struktur padu yang berpusat di wajah (fcc), sama seperti berlian, untuk kristal silikon. Sfera kelabu sesuai dengan atom jika, seperti yang dihargai, mereka kovalen dikaitkan antara satu sama lain; Di samping itu, mereka mempunyai persekitaran tetrahedral yang menghasilkan semula di sepanjang kaca.
Kristal silikon adalah FCC kerana atom diperhatikan jika terletak pada setiap wajah kiub (6 × 1/2). Terdapat juga lapan atom jika di simpul kiub (8 × 1/8), dan empat yang terletak di dalamnya (yang menunjukkan tetrahedron yang ditentukan dengan baik di sekelilingnya, 4 × 1).
Kata di atas, setiap sel unit mempunyai sejumlah lapan atom silikon (3 + 1 + 4, nombor yang ditunjukkan dalam perenggan di atas); Ciri yang membantu menjelaskan kekerasan dan ketegarannya yang tinggi, kerana silikon tulen adalah kristal kovalen dan berlian.
Watak kovalen
Watak kovalen ini disebabkan oleh fakta bahawa, seperti karbon, silikon mempunyai empat elektron valensi mengikut konfigurasi elektroniknya:
[Ne] 3s2 3p2
Untuk menghubungkan, orbital tulen 3s dan 2p tidak berguna. Itulah sebabnya atom mencipta empat orbital hibrid SP3, Yang mana anda boleh membentuk empat ikatan kovalen Si-Si dan, dengan cara ini, selesaikan oktet Valencia untuk dua atom silikon.
Kristal silikon kemudian divisualisasikan sebagai rangkaian kovalen dan tiga dimensi yang terdiri daripada tetrahedra yang saling berkaitan.
Walau bagaimanapun, rangkaian ini tidak sempurna, kerana ia membentangkan kecacatan dan batas bijirin, yang memisahkan dan menentukan kristal dari yang lain; Dan apabila kristal sedemikian sangat kecil dan banyak, terdapat perbincangan tentang pepejal polyristaline, yang dikenal pasti oleh kecerahan heterogennya (serupa dengan mozek atau perak permukaan).
Kekonduksian elektrik
SI-IF menghubungkan, dengan elektron mereka yang terletak dengan baik, pada dasarnya tidak bersetuju dengan apa yang diharapkan dari logam: laut elektron "membasahi" atom mereka; Sekurang -kurangnya, ini begitu pada suhu bilik.
Walau bagaimanapun, apabila suhu meningkat, silikon mula memacu elektrik dan, oleh itu, berkelakuan seperti logam; Iaitu, ia adalah elemen metalloid semikonduktor.
Silikon amorf
Tetraheders silikon tidak selalu mengamalkan corak struktur, tetapi boleh diatur dengan cara yang tidak senonoh; Dan walaupun, dengan atom silikon yang hibridisasi kelihatannya SP3 Tetapi sp2, yang menyumbang untuk meningkatkan lagi tahap gangguan. Oleh itu, terdapat perbincangan mengenai silikon amorf dan bukan kristal.
Dalam silikon amorf terdapat kekosongan elektronik, di mana beberapa atom mereka mempunyai orbital dengan elektron hilang. Terima kasih kepada ini, pepejalnya boleh hidrogen sendiri, menimbulkan pembentukan silikon amorf hidrogenal; iaitu, ia mempunyai pautan Si-H, yang mana tetrahedra disiapkan dalam kedudukan yang tidak senonoh dan sewenang-wenang.
Boleh melayani anda: pautan interatomikBahagian ini kemudiannya disimpulkan dengan mengatakan bahawa silikon boleh dibentangkan dalam tiga jenis pepejal (belum lagi tahap kesuciannya): kristal, polyristaline dan amorfus.
Setiap daripada mereka mempunyai kaedah atau proses pengeluaran tersendiri, serta aplikasi dan dilema ketika memutuskan yang mana dari tiga untuk digunakan, mengetahui kelebihan dan kelemahan mereka.
Di mana dan dapatkan
 Kristal kuarza (silika) adalah salah satu mineral utama dan paling luar biasa di mana silikon terletak. Sumber: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830)
Kristal kuarza (silika) adalah salah satu mineral utama dan paling luar biasa di mana silikon terletak. Sumber: James St. John (https: // www.Flickr.com/foto/jsjgeology/22437758830) Silicon adalah elemen ketujuh yang paling banyak di alam semesta, dan yang kedua di kerak bumi, juga memperkayakan mantel bumi dengan keluarga yang luas mineralnya. Unsur ini dikaitkan dengan luar biasa dengan oksigen, membentuk pelbagai oksida; Antara mereka, silika, begitu juga2, dan silikat (pelbagai komposisi kimia).
Silika dapat dilihat dengan mata kasar di padang pasir dan pantai, kerana pasir terdiri daripada Sio2. Sebaliknya, oksida ini dapat dilihat dalam beberapa polimorf, yang paling biasa: kuarza, amethyst, agate, christobalite, tripoli, coesite, stishovita dan thundimita. Di samping itu, ia boleh didapati dalam pepejal amorf seperti opal dan tanah diatomea.
Sementara itu, silikat, bahkan lebih kaya secara struktural dan kimia. Antara beberapa mineral silicates boleh disebutkan: asbestos (putih, kopi dan kebiruan), feldspar, tanah liat, mycies, zaitun, aluminosilicates, zeolit, amphibe dan pyroxenes.
Secara praktikal, semua batu terdiri daripada silikon dan oksigen, dengan ikatan stabil Si-O mereka, dan silikat dan silikat mereka dicampur dengan oksida logam dan spesies bukan organik.
-Pengurangan silika
Masalah yang mewakili mendapatkan silikon adalah untuk memecahkan pautan Si-O ini, yang mana ketuhar khas dan strategi pengurangan yang baik diperlukan. Bahan mentah untuk proses ini adalah silika berbentuk kuarza, yang bergerak sebelum ini sehingga ia adalah serbuk halus.
Dari silika tanah ini, ia boleh disediakan sama ada oleh silikon amorf atau polyristaline.
Silikon amorf
Secara kecil, dibuat di makmal dan dengan langkah -langkah yang relevan, silika dicampur dengan habuk magnesium dalam periuk lebur dan dibakar dengan ketiadaan udara. Reaksi seterusnya berlaku kemudian:
SIO2(s) + mg (s) => 2mgo (s) + ya (s)
Magnesium dan oksida dihapuskan dengan larutan asid hidroklorik yang dicairkan. Kemudian, baki pepejal dirawat dengan asid fluorhorhoric, sehingga selesai bertindak balas SIO2 yang melebihi; Jika tidak, magnesium yang berlebihan memihak kepada pembentukan silikuro masing -masing, mg2Ya, sebatian yang tidak diingini untuk prosesnya.
SIO2 Ia berubah menjadi gas sif yang tidak menentu4, yang pulih untuk sintesis kimia lain. Akhirnya, adunan silikon amorf dikeringkan di bawah arus hidrogen gas.
Satu lagi kaedah yang serupa untuk mendapatkan silikon amorf adalah menggunakan SF yang sama4 sebelum ini dihasilkan, atau sicl4 (sebelum ini diperoleh). Wap halogenuros silikon ini diluluskan melalui natrium cecair dalam suasana lengai, supaya pengurangan gas dapat diberikan tanpa kehadiran oksigen:
Sicl4(g) + 4NA (l) => ya (s) + 4nacl (l)
Menariknya, dengan silikon amorf, panel solar prestasi tenaga tinggi dihasilkan.
Silikon kristal
Bermula lagi dari silika atau kuarza serbuk, mereka dibawa ke ketuhar arka elektrik, di mana ia bertindak balas dengan kokas. Dengan cara ini, ejen pengurangan tidak lagi menjadi logam tetapi bahan karbon yang tinggi:
SIO2(s) + 2c (s) => ya (s) + 2co (g)
Dalam tindak balas, karbida silikon juga dihasilkan, sic, yang dinetralkan dengan lebihan SIO2 (Sekali lagi kuarza berlebihan):
2sic (s) + sio2(s) => 3Si (s) + 2co (g)
Kaedah lain untuk menyediakan silikon kristal menggunakan aluminium sebagai ejen pengurangan:
3Sio2(s) + 4al (l) => 3si (s) + 2al2Sama ada3(S)
Dan bermula dari kalium hexafluorurosilicate, k2[Sif6], ia juga bertindak balas dengan aluminium logam atau kalium untuk menyebabkan produk yang sama:
K2[Sif6] (l) + 4al (l) => 3si (s) + 6kf (l) + 4Alf3(g)
Segera silikon larut dalam aluminium cair, dan apabila sistem itu menyejukkan, yang pertama mengkristal dan memisahkan dari yang kedua; iaitu, kristal silikon terbentuk, yang kelihatan warna kelabu.
Silikon polyristaline
Tidak seperti sintesis atau produksi yang lain, untuk mendapatkan silikon polyristaline, ia bermula dengan fasa gas silano, SIH4. Gas ini mengalami pirolisis di atas 500 ° C, sedemikian rupa sehingga penguraian haba berlaku dan dengan itu, wap awalnya, mereka akhirnya mendepositkan polyristal silikon pada permukaan semikonduktor.
Persamaan kimia berikut mencontohkan tindak balas yang berlaku:
Ya h4(g) => ya (s) + h2(g)
Jelas sekali, tidak ada oksigen di ruang, kerana ia akan bertindak balas dengan SIH4:
Ya h4(g) + ke -22(g) => sio2(s) + 2h2O (g)
Dan spontan reaksi pembakaran adalah seperti itu, yang berlaku dengan cepat pada suhu bilik di muka.
Laluan sintetik lain untuk menghasilkan bahagian silikon jenis silikon kristal ini sebagai bahan mentah. Mereka membuatnya bertindak balas dengan hidrogen klorida pada suhu sekitar 300 ° C, supaya trichlorosilano dibentuk:
Boleh melayani anda: besi (elemen): ciri, struktur kimia, kegunaanYa (s) + 3Hcl (g) => sicl3H (g) + h2(g)
Dan SICL3H bertindak balas kepada 1100 ºC untuk menjana semula silikon, tetapi sekarang polyristaline:
4SICL3H (g) => ya (s) + 3sicl4(g) + 2h2(g)
Sudah cukup untuk melihat persamaan untuk memberi idea tentang kerja dan parameter pengeluaran yang ketat yang mesti dipertimbangkan.
Isotop
Silikon secara semula jadi dan terutamanya sebagai isotop 28Ya, dengan banyaknya 92.23%.
Di samping itu, terdapat dua isotop lain yang stabil dan oleh itu tidak mengalami kerosakan radioaktif: 29Ya, dengan banyaknya 4.67%; dan 30Ya, dengan banyaknya 3.10%. Sangat banyak 28Ya, tidak menghairankan bahawa berat atom silikon adalah 28,084 u.
Silikon juga boleh berada di beberapa radioisotop, di antaranya 31Yeah (t1/2= 2.62 jam) dan 32Yeah (t1/2= 153 tahun). Yang lain (22Yeah - 44Jika mereka ada t1/2 sangat pendek atau ringkas (kurang dari seratus saat).
Risiko
Silikon tulen adalah bahan yang agak tidak aktif, jadi biasanya tidak terkumpul di mana -mana organ atau tisu selagi pendedahan kepadanya adalah rendah. Dalam bentuk habuk ia boleh menyebabkan kerengsaan mata, menyebabkan air mata atau kemerahan, sambil menyentuhnya boleh menyebabkan ketidakselesaan kulit, gatal -gatal dan mengelupas.
Apabila pendedahannya sangat tinggi, silikon boleh menyakiti paru -paru; Tetapi tanpa kesan berikutnya, melainkan jumlahnya cukup untuk menyebabkan lemas. Walau bagaimanapun, ini tidak berlaku dengan kuarza, yang dikaitkan dengan kanser paru -paru dan penyakit seperti bronkitis dan emfisema.
Begitu juga, silikon tulen sangat jarang berlaku, dan sebatiannya, begitu banyak di kerak bumi, tidak mewakili risiko terhadap alam sekitar.
Sekarang, berkenaan dengan organ -organ, ini boleh menjadi toksik; Tetapi mempunyai banyak daripada mereka bergantung kepada mana yang dipertimbangkan, serta faktor lain (kereaktifan, pH, mekanisme tindakan, dll.).
Aplikasi
Industri Pembinaan
Mineral silikon mengintegrasikan "batu" dengan bangunan, rumah, atau monumen yang dibina. Sebagai contoh, simen, konkrit, stuko dan batu bata refraktori, terdiri daripada campuran pepejal berdasarkan silikat. Dari pendekatan ini, seseorang dapat muncul utiliti yang dimiliki oleh elemen ini di bandar dan seni bina.
Kaca dan seramik
Dari silika, kristal yang digunakan pada peranti optik boleh dihasilkan, sama ada sebagai penebat, sel untuk sampel spektrofotometer, kristal piezoelektrik atau gelas semata -mata.
Juga, apabila bahan itu disediakan dengan pelbagai bahan tambahan, ia akhirnya berubah menjadi pepejal amorf, yang dikenali sebagai kaca; dan gunung pasir biasanya merupakan sumber silika atau kuarza yang diperlukan untuk pengeluarannya. Sebaliknya, dengan bahan -bahan seramik dan porselin silicates dihasilkan.
Menghubungkan idea, silikon juga terdapat dalam kraf dan hiasan.
Aloi
Atom silikon boleh bersatu padu dan boleh didapati dengan matriks logam, jadi ia adalah bahan tambahan untuk pelbagai aloi atau logam; Sebagai contoh, keluli, untuk mengeluarkan nukleus magnet; Bronzes, untuk pembuatan kabel telefon; dan aluminium, dalam pengeluaran aloi aluminium-sailicio untuk bahagian automotif ringan.
Oleh itu, bukan sahaja dapat dijumpai di "batu" bangunan, tetapi juga dalam logam lajur mereka.
Desiccants
 Bola silika gelatin, digunakan sebagai pengering. Sumber: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Bola silika gelatin, digunakan sebagai pengering. Sumber: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Silika, dalam bentuk gel atau amorf, membolehkan untuk mengeluarkan pepejal yang bertindak sebagai desiccants ketika menangkap molekul air yang memasuki bekas dan mengekalkan pedalaman mereka kering.
Industri Elektronik
 Silikon polyristal dan amorf digunakan untuk pembuatan panel solar. Sumber: Pxhere.
Silikon polyristal dan amorf digunakan untuk pembuatan panel solar. Sumber: Pxhere. Lapisan silikon ketebalan dan warna yang berbeza adalah sebahagian daripada cip komputer, serta dengan pepejal (kristal atau amorf), litar bersepadu dan sel solar telah direka.
Menjadi semikonduktor, atom diperbadankan dengan kurang (al, b, ga) atau lebih elektron (p, as, sb) untuk mengubahnya menjadi jenis semikonduktor p Sama ada n, masing -masing. Dengan dua kesatuan silikon, satu n dan yang lain p, diod pemancar cahaya dihasilkan.
Polimer silikon
Gam silikon yang terkenal terdiri daripada polimer organik yang disokong oleh kestabilan rantai pautan Si-O-Si ... jika rantai ini sangat panjang, pendek atau silang, sifat-sifat perubahan polimer silikon, serta mereka aplikasi akhir.
Antara kegunaannya, perkara berikut boleh disebutkan di bawah:
-Gam atau pelekat, bukan sahaja untuk menyertai kertas, tetapi blok pembinaan, karet, panel kaca, batu, dll.
-Pelincir dalam sistem brek hidraulik
-Mengukuhkan lukisan dan meningkatkan kecerahan dan intensiti warna mereka, pada masa yang sama yang membolehkan anda menahan perubahan suhu tanpa retak atau carcome
-Ia digunakan sebagai semburan air penghalau, yang tetap kering beberapa permukaan atau objek
-Mereka memberikan produk kebersihan peribadi (pasta gigi, syampu, gel, krim pisau cukur, dll.) Perasaan menjadi sutera
-Lapisannya melindungi komponen elektronik peranti halus dari haba dan kelembapan, seperti mikropemproses
-Dengan polimer silikon, beberapa bola getah yang melantun hampir tidak jatuh ke lantai.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Silikon. Diperoleh dari: dalam.Wikipedia.org
- Mikrokimia. (s.F.). Crystallography silikon. Pulih dari: mikrokimia.com
- Lentech b.V. (2019). Jadual Tempoh: Silikon. Pulih dari: lentech.com
- Marques Miguel. (s.F.). Silikon berlaku. Pulih dari: nautilus.Fis.UC.Pt
- Lebih banyak hemant. (5 November 2017). Silikon. Pulih dari: Hemantmore.org.dalam
- Pilgaard Michael. (22 Ogos 2018). Silikon: Kejadian, Pengasingan & Sintesis. Pulih dari: pilgaardelegs.com
- Dr. Doug Stewart. (2019). Fakta elemen silikon. Chemicool. Pulih dari: chemicool.com
- Christiana Honsberg dan Stuart Bowden. (2019). Koleksi sumber untuk pendidik fotovoltaik. Pveducation. Diperolehi dari: pveducation.org
- Majlis Kimia Amerika, Inc. (2019). Silikon dalam kehidupan seharian. Pulih dari: SEHSC.Americachemistry.com
- « Jenis dan contoh strategi pengedaran
- Jenis strategi produk, bagaimana ia dilakukan dan contohnya »

