Komponen penyelesaian hipotonik, penyediaan, contoh
- 939
- 37
- Ms. Micheal Rippin
A Penyelesaian hipotonik Ia adalah salah satu yang membentangkan kepekatan larut kecil berkenaan dengan penyelesaian yang dipisahkan atau diasingkan oleh pepijat semiperman. Halangan ini membolehkan pelarut menjadi transte, air dalam kes sistem biologi, tetapi tidak semua zarah larut.
Cecair badan vertebrata intraselular dan ekstraselular mempunyai osmolariti sekitar 300 mosm/l. Walaupun dianggap bahawa cecair hipotonik mempunyai osmolarity kurang daripada 280 mosm/l. Oleh itu, penyelesaian osmolariti ini adalah hipotonik berhubung dengan medium selular.
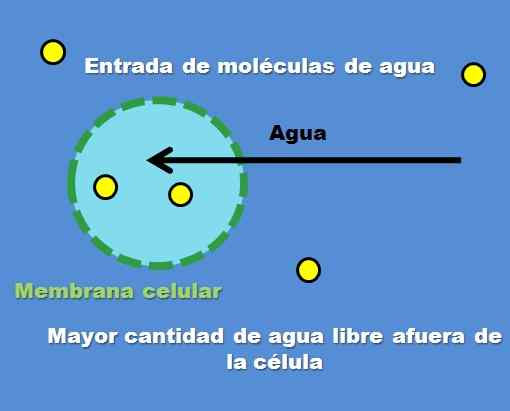
 Interaksi sel dengan penyelesaian hipotonik. Sumber: Gabriel Bolívar.
Interaksi sel dengan penyelesaian hipotonik. Sumber: Gabriel Bolívar. Contoh penyelesaian hipotonik ialah 0.45% natrium klorida. Tetapi bagaimana sel atau petak berkelakuan di hadapan penyelesaian jenis ini? Imej unggul menjawab soalan ini.
Kepekatan zarah larut (titik kuning) lebih tinggi di dalam sel luar. Mempunyai kurang larutan di sekitar sel, terdapat lebih banyak molekul air percuma, jadi ia diwakili dengan warna biru yang lebih sengit berbanding bahagian dalam sel.
Air mengalir ke luar melalui osmosis ke tahap kepekatan. Akibatnya, sel berkembang atau kipas dengan menyerap air yang melintasi membran selnya.
[TOC]
Komponen penyelesaian hipotonik
Penyelesaian hipotonik terdiri daripada pelarut yang, melainkan dinyatakan sebaliknya, terdiri daripada air, dan larutan dibubarkan di dalamnya seperti garam, gula, dll., dalam bentuk tulen atau bercampur. Tetapi penyelesaian ini tidak akan mempunyai sebarang tonik jika tidak ada halangan semipermeable, yang menjadi membran sel.
Ia boleh melayani anda: kalsium nitrat (CA (NO3) 2)Mesti ada sedikit garam dibubarkan sehingga kepekatannya kecil, sementara "kepekatan" airnya tinggi. Mempunyai lebih banyak air bebas di luar sel, ia.
Penyediaan penyelesaian hipotonik
Untuk penyediaan penyelesaian ini, protokol yang sama diikuti seperti yang diikuti untuk penyelesaian lain. Pengiraan jisim larut yang sesuai dibuat. Maka ini ditimbang, larut dalam air dan mengambil bendera yang dikongsi bersama dengan jumlah yang sepadan dengannya.
Penyelesaian hipotonik mempunyai osmolariti yang rendah, biasanya kurang daripada 280 mosm/l. Oleh itu, apabila menyediakan penyelesaian hipotonik, kita mesti mengira osmolariti anda sedemikian rupa sehingga nilainya kurang daripada 280 mosm/l. Osmolarity boleh dikira dengan persamaan berikut:
Osmolarity = m · v · g
Di mana m Ia adalah molariti larut, dan v Bilangan zarah di mana sebatian dipisahkan dalam penyelesaian. Bahan bukan elektrolitik tidak dipisahkan, jadi nilai v adalah sama dengan 1. Ini adalah kes glukosa dan gula lain.
Manakala g adalah pekali osmotik. Ini adalah faktor pembetulan untuk interaksi zarah -zarah yang dikenakan elektrik (ion) dalam penyelesaian. Untuk penyelesaian yang dicairkan dan bahan -bahan yang tidak disangkal, contohnya glukosa, nilai g sama dengan 1 diambil. Kemudian dikatakan bahawa molariti adalah sama dengan osmolaritasnya.
Contoh 1
Sediakan penyelesaian natrium klorida (NaCl) pada 0.5 % (p/v) Memeriksa sama ada ia adalah penyelesaian hipotonik. Berat molekul NaCl = 58.5 g/mol.
0.5 % penyelesaian gram NaCl seliter dibawa:
Boleh melayani anda: kalsium peroksida (CaO2): sifat, risiko dan kegunaanNaCl dalam g/l = (0.5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
Dan kami terus mengira molaritasnya dan kemudian menentukan osmolaritasnya:
Molariti = jisim (g/l) ÷ berat molekul (g/mol)
= 5 g/l ÷ 58.5 g/mol
= 0.085 mol/l
NaCl memisahkan dua zarah: na+ (kation) dan Cl- (Anion). Jadi nilai v = 2. Juga, kerana ia adalah penyelesaian 0.5 %NaCl yang dicairkan, dapat diandaikan bahawa nilai g (pekali osmotik) adalah 1. Kami ada:
Osmolarity (NaCl) = molarity · v · g
= 0.085 m · 2 · 1
= 0.170 OSM/L O 170 mosm/l
Ini adalah penyelesaian hipotonik, kerana osmolaritasnya jauh lebih rendah daripada osmolaritas rujukan untuk cecair badan iaitu osmolaritas plasma yang nilainya adalah sekitar 300 mosm/l l.
Contoh 2
Sediakan penyelesaian campuran kalsium klorida (CACL2) pada 0.055 % (p/v) dan glukosa (c6H12Sama ada6) pada 4 % (p/v). Berat molekul: CACL2 = 111 g/mol dan c6H12Sama ada6 = 180 g/mol.
Kami mengira molariti yang mempunyai kepekatan larutan masing -masing pada 0.55 g/l dan 40 g/l:
Molariti (CaCl2) = 0.55 g/l ÷ 111 g/mol
= 4.95 · 10-3 M
= 4.95 mm
Molariti (c6H12Sama ada6) = 40 g/l ÷ 180 g/mol
= 0.222 m
= 222 mm
Dan dengan cara yang sama kita mengira osmolariti, mengetahui bahawa klik itu2 Ia memisahkan tiga ion, dua cl- Dan ca2+, dan mengandaikan bahawa mereka adalah penyelesaian yang sangat dicairkan, jadi nilai v Ia adalah 1. Kami ada:
Osmolarity (CaCl2) = 4.95 mm · 3 · 1
= 14.85 mosm/l
Osmolariti (c6H12Sama ada6) = 222 mm · 1 · 1
= 222 mosm/l
Akhirnya, jumlah osmolariti penyelesaian menjadi jumlah osmolariti individu; iaitu, dari NaCl dan glukosa. Oleh itu, ini:
Boleh melayani anda: bahan refraktoriJumlah osmolariti larutan = CaCl Osmolarity2 + Osmolarity c6H12Sama ada6
= 222 mosm/l + 14.85 mosm/l
= 236.85 mosm/l
Penyelesaian campuran kalsium dan glukosa klorida adalah hipotonik, kerana osmolaritasnya (236.85 mosm/l) jauh lebih rendah daripada osmolariti plasma (300 mosm/l), yang diambil sebagai rujukan.
Contoh penyelesaian hipotonik
Penyelesaian natrium klorida
Penyelesaian natrium klorida 0.45 % secara intravena diberikan kepada pesakit ketosis diabetes yang mengalami dehidrasi dalam petak interstisial dan intraselular. Air mengalir dari plasma ke petak tersebut.
Penyelesaian Laktat Ringer
Penyelesaian Laktat Ringer No. 19 adalah satu lagi contoh penyelesaian hipotonik. Komposisinya ialah 0.6 g natrium klorida, 0.03 g kalium klorida, 0.02 g kalsium klorida, 0.31 g natrium laktat, dan 100 mL air sulingan. Ia adalah penyelesaian yang digunakan untuk rehidrasi pesakit dan sedikit hipotonik (274 mosm/l).
Rujukan
- Dari lehr spilva, ke. Dan Muktans, dan. (1999). Panduan Kepakaran Farmaseutikal di Venezuela. Edisi xxxvª. Edisi global.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Tonik. Diperoleh dari: dalam.Wikipedia.org
- Union Media LLC. (2020). Penyelesaian isotonik, hipotonik, dan hipertonik. Diperolehi dari: UniEtestPrep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Seksyen 15.8osmosis, saluran air, dan peraturan jumlah sel. NCBI Bookshelf. Pulih dari: NCBI.NLM.NIH.Gov
- John Brennan. (13 Mac, 2018). Cara mengira isotoni. Pulih dari: saintifik.com

