Struktur sulfat mangan (MNSO4), sifat, mendapatkan, menggunakan

- 2098
- 468
- Horace Gulgowski
Dia sulfat mangan (II) Ia adalah pepejal bukan organik yang dibentuk oleh unsur mangan (MN), sulfur dan oksigen (O). Formula kimianya adalah MSO4. Bentuk anhydrous (tanpa air dalam strukturnya) adalah pepejal putih. Walau bagaimanapun, ia mempunyai beberapa bentuk terhidrasi dan semuanya adalah pepejal merah jambu.
Sulfat mangan dalam jumlah yang sangat kecil (kecil) digunakan sebagai mikronutrien untuk kedua -dua haiwan dan manusia, kerana ia diperlukan untuk fungsi normal organisma.
 Mangan sulfat anhidro mnso4. YOSF0113 di Bahasa Inggeris Wikipedia / Domain Awam. Sumber: Wikimedia Commons.
Mangan sulfat anhidro mnso4. YOSF0113 di Bahasa Inggeris Wikipedia / Domain Awam. Sumber: Wikimedia Commons. Ia juga ditambah bersama dengan baja tertentu dalam tanah yang kekurangan dalam mangan (MN) untuk tanaman pertanian yang memerlukannya, seperti tumbuhan anggur.
Oleh kerana pewarna merah jambu jenis terhidratnya, ia digunakan dalam pigmen yang berfungsi untuk melukis seramik, pewarna kain dan bahan lain. Ia juga berfungsi untuk mendapatkan sebatian mangan lain.
Mons4 mesti dimanipulasi dengan teliti. Penyedutannya boleh menyebabkan masalah pernafasan dan menghasilkan kesulitan yang serius dalam sistem saraf, termasuk gejala yang serupa dengan penyakit Parkinson.
Kelebihannya juga boleh menyebabkan kerosakan pada haiwan dan tumbuhan tanah dan akuatik.
[TOC]
Struktur
Sulfat mangan anhydrous (tanpa air dalam struktur kristalnya) dibentuk oleh ion mangan dalam pengoksidaan +2, iaitu, Mn2+ dan anion sulfat begitu42-.
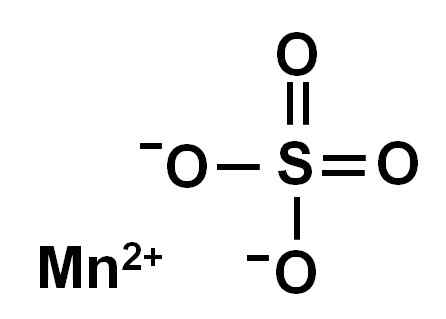 Struktur kimia sulfat mangan4. Pengarang: Marilú Stea.
Struktur kimia sulfat mangan4. Pengarang: Marilú Stea. Nomenclature
- Sulfat mangan (II)
- Mangan monosulfat
- Mangan sulfat anhidro mnso4
- Mangan sulfat mangan mangan4 •H2Sama ada
- Tetrahydrate mangan sulfat mso4 •4H2Sama ada
- Mangan sulfat pentahydrate4 •5h2Sama ada
- Hepthydrated mangan sulfat4 •7h2Sama ada
Sifat
Keadaan fizikal
Mons4 anhydrous (tanpa air dalam strukturnya) adalah pepejal putih kristal. Walau bagaimanapun, jenis terhidrat berwarna merah jambu atau pepejal merah pucat.
 Manganeso sulfat tetrahydrate mnso4.4H2Atau padat merah jambu. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons.
Manganeso sulfat tetrahydrate mnso4.4H2Atau padat merah jambu. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons. Berat molekul
Msso4 = 151 g/mol
Msso4 •H2O = 169.02 g/mol
Takat lebur
MSSO anhydrous4 = 700 ºC
Monohydrate MSO4 •H2O = 400-450 ° C
Menso Tetrahydrate4 •4H2O = 30 ° C
Takat didih
MSSO anhydrous4 = Ia terurai pada 850 ºC.
Ia boleh melayani anda: kobalt klorida (cocl2 (: struktur, nomenclature, sifatMenso Tetrahydrate4 •4H2O = 850 ° C
Ketumpatan
Msso4 = 3.25 g/cm3
Msso4 •H2O = 2.95 g/cm3
Kelarutan
Sangat larut dalam air: 52 g/100 ml air pada suhu 5 ° C. Larut alkohol. Tidak larut dalam eter. Sedikit larut dalam metanol.
Ph
Penyelesaian Monse4 •H2Atau 5% mempunyai pH 3.7.
Sifat kimia
Apabila melarutkan air, MnSO4 dipisahkan ke dalam ion Mnnya2+ Dan juga42-.
Ion mangan (ii) mn2+ Dalam larutan asid atau neutral ia dikaitkan dengan 6 molekul air2Atau membentuk ion hexaacuomanganese [mn (h2Sama ada)6]2+, yang merah jambu.
Ion hexaacuomanganese [mn (h (h2Sama ada)6]2+ Ia agak tahan terhadap pengoksidaan. Dalam medium asas (alkali pH) ion ini menjadi mangan hidroksida (ii) mn (OH)2, yang mudah dioksidakan, membentuk sebatian mangan (iii) dan mangan (iv).
 Penyelesaian MSSO4 Asid berwarna merah jambu dengan kehadiran ion hexaacuomanganese [mn (h (h2Sama ada)6]2+. Pengarang: Steve Cross. Sumber: Pixabay.Sulfat mangan mempunyai beberapa bentuk terhidrat, iaitu, dengan air h2Atau dalam struktur kristalnya.
Penyelesaian MSSO4 Asid berwarna merah jambu dengan kehadiran ion hexaacuomanganese [mn (h (h2Sama ada)6]2+. Pengarang: Steve Cross. Sumber: Pixabay.Sulfat mangan mempunyai beberapa bentuk terhidrat, iaitu, dengan air h2Atau dalam struktur kristalnya.
Ini adalah MSO monohidrat4 •H2Atau, tetrahydrate MSO4 •4H2Atau, mnse pentahydrate4 •5h2O dan Hepthydrate MSO4 •7h2Sama ada. Bentuk terhidrat ini mengandungi ion hexaacuomanganese [mn (h (h2Sama ada)6]2+ Dalam kristal mereka dan atas sebab ini mereka adalah pepejal merah jambu.
Monohydrate Menso4 •H2Atau ia sedikit effloresen, yang bermaksud bahawa ia kehilangan beberapa air penghidratan perlahan -lahan apabila ia terdedah kepada alam sekitar.
Memperoleh
Mons4 boleh didapati dengan merawat mangan oksida (ii) mno, mn manghanous hidroksida (OH)2 O mangan Karbonat (II) MNCO3 Dengan asid sulfurik h2SW4.
Mnco3 + H2SW4 → MSSO4 + H2Atau + co2
Aplikasi
Sebagai pelengkap pemakanan
Sulfat mangan dalam kuantiti kecil berfungsi dengan fungsi badan dan haiwan tertentu.
Itulah sebabnya penting sebagai sebatian berguna dalam pemakanan dan dibekalkan sebagai makanan tambahan. Ia digunakan dalam jejak (kuantiti yang sangat kecil).
Jumlah yang tinggi boleh menjadi sangat toksik dan berbahaya.
Dalam Perubatan Veterinar
Mons4 Burung Corral (ayam, ayam belanda, itik dan Phaisanes) ditadbir untuk mencegah kekurangan atau kekurangan elemen mangan dalam haiwan ini.
Boleh melayani anda: Potassium iodate (kio3)Kekurangan mangan ditunjukkan di dalamnya, sebagai contoh, seperti penyakit yang dipanggil perosis, yang merupakan ubah bentuk tulang kaki burung muda.
 Patitos mungkin memerlukan jejak monste4 Dalam dietnya untuk mencegah perosis. Penulis: s. Hermann & F. Richter. Sumber: Pixabay.
Patitos mungkin memerlukan jejak monste4 Dalam dietnya untuk mencegah perosis. Penulis: s. Hermann & F. Richter. Sumber: Pixabay. Ia terpakai untuk memberi makan burung -burung ini dalam jumlah atau jejak yang sangat kecil.
Dalam bidang pertanian
Sulfat mangan digunakan sebagai mikronutrien dalam baja untuk anggur (tumbuhan anggur) dan ladang tembakau dalam tangga kekurangan dalam mangan.
Walau bagaimanapun, beberapa kajian menunjukkan bahawa sulfat mangan yang berlebihan dapat menghalang atau mengurangkan pembentukan enzim penting tertentu untuk pertumbuhan tumbuhan dan wabak mereka.
 Dalam beberapa kes ia terpakai MNSO4 ke tanah di mana tumbuh -tumbuhan anggur. Pengarang: Schwoaze. Sumber: Pixabay.
Dalam beberapa kes ia terpakai MNSO4 ke tanah di mana tumbuh -tumbuhan anggur. Pengarang: Schwoaze. Sumber: Pixabay. Sebagai contoh, didapati bahawa ia adalah toksik kepada beberapa tanaman seperti kapas.
Mons4 Ia juga digunakan dalam fungisida dan bersama -sama dengan sebatian organik tertentu adalah sebahagian daripada racun perosak tertentu.
Dalam beberapa aplikasi
Mons4 Terhidrasi digunakan oleh pewarnaannya untuk menyediakan pigmen bukan organik yang digunakan dalam varnis merah untuk seramik, dalam kain dan bahan lain pewarna.
Sulfat mangan digunakan dalam pembuatan kaca dan sabun juga disediakan dengannya.
 Beberapa jubin seramik boleh mengandungi pigmen sulfat mangan. Pengarang: Dwilliams. Sumber: Pixabay.
Beberapa jubin seramik boleh mengandungi pigmen sulfat mangan. Pengarang: Dwilliams. Sumber: Pixabay. Mons4 Ia adalah bahan permulaan untuk mendapatkan elektrolitik logam mangan (MN), iaitu, dengan menggunakan elektrik untuk penyelesaian berair.
Ia juga membolehkan anda mendapatkan mangan dioksida2 dan karbonat mangan3.
Mons4 Ia juga digunakan untuk analisis kimia dan dalam perumusan penyelesaian yang digunakan dalam eksperimen genetik dengan mikroorganisma.
Risiko
Sulfat mangan mengandungi ion mangan (ii) (mn2+), yang boleh menjadi tidak berbahaya dan toksik bergantung kepada jumlah yang mana orang, haiwan atau tumbuhan terdedah.
Mangan adalah penting untuk fungsi normal organisma manusia, haiwan dan beberapa tumbuh -tumbuhan. Tetapi malangnya mangan juga neurotoksik, iaitu, ia mempengaruhi sistem saraf dan beberapa fungsi tumbuhan.
Boleh melayani anda: Siapa yang merancang termometer moden yang pertama?Jumlah yang selamat
Mons4 Ditadbir dengan makanan berbentuk makanan (kuantiti yang sangat kecil atau kecil) umumnya selamat oleh pentadbiran makanan dan ubat, atau FDA (akronim untuk bahasa Inggeris Pentadbiran Makanan dan Ubat-Ubatan).
Jumlah berbahaya
Pendedahan yang berpanjangan atau berulang kepada sebatian ini dalam kuantiti yang ketara boleh menyebabkan kemudaratan kepada manusia dan haiwan.
Ia menghasilkan kerengsaan di mata mukus dan membran mukus saluran pernafasan, anoreksia, sakit kepala, kehilangan keseimbangan, radang paru -paru dan jangkitan pernafasan.
Penyedutan kronik menyebabkan kerosakan pada sistem saraf, menghasilkan Manghanisme, gegaran dengan tangan dan gejala penyakit Parkinson yang biasa.
 Sulfat mangan mempengaruhi sistem saraf. Pengarang: Sabine Zierer. Sumber: Pixabay.
Sulfat mangan mempengaruhi sistem saraf. Pengarang: Sabine Zierer. Sumber: Pixabay. Oleh itu, penyebaran habuk MSO harus dielakkan4, Gunakan peralatan pernafasan dan sarung tangan pelindung.
Ia beracun untuk kehidupan akuatik dan dalam ini menghasilkan kesan panjang. Ia mesti disimpan di tempat di mana tidak ada akses ke sistem saliran atau pembetungan. Sangat penting untuk tidak membiarkannya dibuang di alam sekitar.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Sulfat mangan. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Ensiklopedia Kimia Perindustrian Ullmann. (1990). Edisi Kelima. Jilid A22. VCH Verlagsgellschaft MBH.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Mangan sulfat monohidrat. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Dunham, m.J. (2010). Panduan kepada Genetik Yast: Genomik Fungsian, Proteomik, dan Analisis Sistem Lain. Formulasi sederhana. Dalam kaedah dalam enzimologi. Pulih dari Scientedirect.com.
- Saric, m. dan Lucchini, r. (2007). Mangan. Anda gunakan. Dalam Buku Panduan mengenai Toksikologi Logam (Edisi Ketiga). Pulih dari Scientedirect.com.
- Vallero, d. (2014). Kesan neurologi polutan udara. Mangan. Dalam dana pencemaran udara (edisi kelima). Pulih dari Scientedirect.com.
- Chee, r. (1986). In vitro Budaya Vitis: Kesan spektrum cahaya mangan sulfat dan kalium iodida pada morfogenesis. Sel tumbuhan, Tiss dan Organ Cult 7: 121-134 (1986). Pautan pulih.Springer.com.
- « Struktur, Ciri, Ciri -ciri, Latihan Secbutil, Latihan
- +125 kata -kata pendek dan popular [dengan makna] »

