Zink sulfida (ZnS)
- 989
- 198
- Mr. Tracy Parisian
 Zink sulfida. Sumber: Wikimedia Commons
Zink sulfida. Sumber: Wikimedia Commons Apa itu zink sulfida?
Dia Zink sulfida Ia adalah sebatian formula z yang tidak organiknS, dibentuk oleh kation Zn2+ dan anion s2-. Ia didapati secara semula jadi sebagai dua mineral: wurtzite dan spheny (atau zink blenda), yang terakhir menjadi bentuk utamanya.
Sphenhell dibentangkan dalam sifat hitam kerana kekotoran yang dibentangkannya. Semata -mata membentangkan kristal putih, sementara wurtzita mempunyai kristal putih kelabu.
Zink sulfida tidak larut dalam air. Ia boleh menyebabkan kerosakan alam sekitar, kerana ia menembusi tanah dan mencemarkan air bawah tanah dan arus mereka.
Zink sulfida boleh berlaku, antara tindak balas, kakisan dan peneutralan lain.
Oleh kakisan:
Zn +H2S => zns +h2
Oleh peneutralan:
H2S +zn (oh)2 => Zns +2h2Sama ada
Zink sulfida adalah garam fosforus, yang memberikan kapasiti kegunaan dan aplikasi berganda. Di samping itu, ia adalah semikonduktor dan photocatizing.
Struktur sulfida zink
Zink sulfida mengamalkan struktur kristal yang dikawal oleh tarikan elektrostatik antara kation Zn2+ dan anion s2-. Ini adalah dua: spheny atau zink campuran, dan wurzita. Dalam kedua -dua ion meminimumkan penolakan antara ion yang sama.
Zink Blenda adalah yang paling stabil dalam keadaan tekanan dan suhu daratan; Dan wurzita, yang kurang padat, hasil daripada penyusunan semula kristal kerana peningkatan suhu.
Kedua -dua struktur ini dapat wujud bersama dalam ZnS yang sama pepejal pada masa yang sama walaupun, sangat perlahan, wurzita akan berakhir dengan mendominasi.
Zinc Blenda
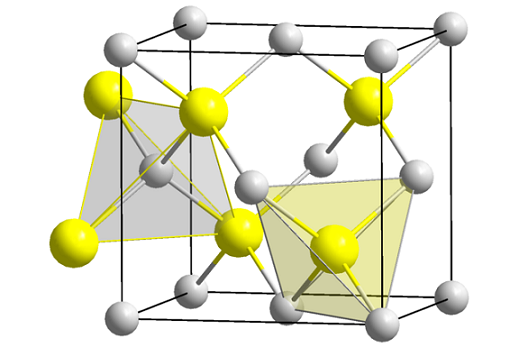
 Struktur Blenda Zink (Spheny). Sumber: Wikimedia Commons
Struktur Blenda Zink (Spheny). Sumber: Wikimedia Commons Imej unggul menunjukkan sel padu yang berpusat pada wajah struktur zink campuran. Sfera kuning sesuai dengan anion s2-, dan kelabu ke kation Zn2+, Terletak di sudut dan di pusat -pusat wajah kiub.
Boleh melayani anda: isobutil: nomenclature, latihan, struktur dan ciriPerhatikan geometri tetrahedral di sekitar ion. Zink Blenda juga boleh diwakili oleh tetrahedra ini, yang lubang di dalam kaca mempunyai geometri yang sama (tetrahedral hollows).
Juga, perkadaran ZnS dipenuhi dalam sel unit; iaitu, bahagian 1: 1. Oleh itu, untuk setiap kation Zn2+ Ada anion s2-. Dalam imej itu mungkin kelihatan bahawa sfera kelabu berlimpah, tetapi pada hakikatnya ketika mereka berada di sudut dan pusat wajah hab mereka dikongsi oleh sel -sel lain.
Sebagai contoh, jika empat sfera kuning yang berada di dalam kotak diambil, "kepingan" semua sfera kelabu di sekitar harus menambah yang sama (dan berbuat demikian), empat. Oleh itu, di sel kesatuan padu terdapat empat Zn2+ dan empat s2-, Perkadaran stoikiometrik ZnS dipenuhi.
Begitu juga, penting untuk menekankan bahawa terdapat lubang tetrahedral ke hadapan dan di belakang sfera kuning (ruang yang memisahkannya dari satu sama lain).
Wurzita
 Struktur Wurzite. Sumber: Wikimedia Commons
Struktur Wurzite. Sumber: Wikimedia Commons Tidak seperti struktur zink Blenda, Wurzita mengamalkan sistem kristal heksagon (imej unggul). Ini kurang padat, jadi pepejal mempunyai ketumpatan yang kurang.
Ion di Wurzita juga mempunyai persekitaran tetrahedral dan perkadaran 1: 1 yang sesuai dengan formula ZnS.
Ciri -ciri zink sulfida
Warna
Ia boleh dibentangkan dalam tiga cara:
-Wurtzita, kristal putih dan heksagon.
-Sphenhell, kristal putih dan kristal padu.
-Sebagai serbuk putih berwarna putih ke kelabu atau kekuningan, dan kristal kekuningan padu.
Takat lebur
1.700 ° C.
Kelarutan air
Hampir tidak larut (0.00069 g/100 ml pada 18 ° C).
Kelarutan
Tidak larut dalam alkali, larut dalam asid mineral yang dicairkan.
Ketumpatan
Sfera 4.04 g/cm3 dan Wurtzita 4.09 g/cm3.
Kekerasan
Ia mempunyai kekerasan 3 hingga 4 pada skala mohs.
Kestabilan
Apabila mengandungi air perlahan -lahan mengoksidakan sulfat. Dalam persekitaran yang kering ia stabil.
Penguraian
Apabila dipanaskan pada suhu tinggi, dia mengeluarkan zink toksik dan sulfur oksida.
Ia boleh melayani anda: natrium hidrida (nah): sifat, kereaktifan, bahaya, kegunaanNomenklatur Zink Sulfida
Konfigurasi elektronik Zn adalah [AR] 3D104s2. Semasa kehilangan dua elektron orbital 4s, ia seperti Zn Cation2+ Dengan orbitalnya penuh. Oleh itu, sejak Zn secara elektronik2+ Ia jauh lebih stabil daripada Zn+, Ia hanya mempunyai valensi +2.
Oleh itu, ia ditinggalkan untuk tatanama stok, menambah valensi yang tertutup dalam kurungan dan dengan nombor Rom: zink sulfida (ii).
Nomenclatures sistematik dan tradisional
Tetapi ada cara lain untuk memanggil ZnS sebagai tambahan kepada yang sudah dibangkitkan. Dalam sistematik, bilangan atom setiap elemen ditentukan dengan pengangka Yunani, dengan satu -satunya pengecualian elemen ke kanan apabila hanya satu. Oleh itu, ZnS dinamakan sebagai: rotizink sulfida (dan bukan monozinc monosulfuro).
Mengenai tatanama tradisional, ke zink ketika mempunyai valensi tunggal +2, ia ditambah dengan menambahkan akhiran -co. Akibatnya, nama tradisionalnya ialah: Zínc SulfideICO.
Kegunaan zink sulfida
Sebagai pigmen atau lapisan
Sachtolith
Sachtholith adalah pigmen putih yang dibuat dengan zink sulfida. Ia digunakan dalam putties, mastiques, pengedap, penutup bawah, cat lateks dan papan tanda.
Penggunaannya digabungkan dengan pigmen penyerap cahaya ultraviolet, seperti titanium mikro atau pigmen oksida besi telus, diperlukan dalam pigmen tahan cuaca.
ZnS dan lukisan lateks
Apabila ZnS digunakan dalam lukisan lateks atau bertekstur, ia mempunyai tindakan mikroba yang berpanjangan.
Bingkai tingkap dan pesawat
Kerana kekerasan dan ketahanannya yang besar terhadap kerosakan, hakisan, hujan atau debu, ia menjadikannya sesuai untuk tingkap inframerah luaran atau dalam bingkai pesawat.
Lapisan dan kegunaan lain
ZnS digunakan dalam salutan rotor yang digunakan dalam pengangkutan sebatian, untuk mengurangkan haus. Di samping itu, ia digunakan dalam pengeluaran dakwat cetak, sebatian penebat, pigmentasi termoplastik, plastik tahan terhadap api dan lampu elektroluminescent.
Boleh melayani anda: Tunsen lebih ringan: ciri, fungsi, contoh penggunaanPeranti dan skrin penglihatan malam
-Zink sulfida boleh telus, dapat digunakan sebagai tingkap untuk optik yang kelihatan dan optik inframerah. Ia digunakan dalam peranti penglihatan malam, di skrin televisyen, skrin radar dan lapisan pendarfluor.
Electroluminescence
ZnS doping dengan Cu digunakan dalam pengeluaran panel electroluminescence. Di samping itu, ia digunakan dalam pendorong roket dan gravimetri.
Untuk fosforeninya
Penghitungannya digunakan untuk mewarnai jarum jam dan dengan itu menggambarkan masa dalam kegelapan; Juga dalam lukisan untuk mainan, isyarat kecemasan dan notis lalu lintas.
Fosforensi membolehkan penggunaan zink sulfida dalam tiub sinar katod dan pada skrin x -ray untuk bersinar di titik gelap. Warna fosforensi bergantung pada pengaktif yang digunakan.
Semikonduktor, photocatizing dan pemangkin
- Spheny dan wurtzite adalah semikonduktor celah jalur lebar. Sphalerite mempunyai cleft band 3.54 EV, manakala Wurtzita mempunyai bit 3.91 eV -band.
- ZnS digunakan dalam penyediaan photocatalyst yang terdiri daripada Cd - ZnS/Zirconium - titanium fosfat, yang digunakan untuk pengeluaran hidrogen di bawah cahaya yang kelihatan.
- Campur tangan sebagai pemangkin untuk kemerosotan bahan pencemar organik. Ia digunakan dalam penyediaan penyegerakan warna dalam lampu LED.
- Nanocrystals digunakan untuk pengesanan protein ultrasensible. Sebagai contoh, dengan mengeluarkan titik kuantum ZnS. Ia digunakan dalam penyediaan gabungan photocatalyst (CdS/ZnS) -tio2 untuk pengeluaran elektrik melalui fotoelectrocatalysis.
Rujukan
- PubChem (2018). Zink sulfida. Diambil dari: pubchem.NCBI.NLM.NIH.Gov
- Quiminet (16 Januari 2015). Pigmen putih berdasarkan zink sulfida. Pulih dari: quiminet.com
- Wikipedia (2018). Zink sulfida. Diambil dari: dalam.Wikipedia.org
- II-VI UK (2015). Zink sulfida (ZnS). Diambil dari: ii-vi.adalah
- Rob Toreki (30 Mac 2015). Struktur zincblende (ZnS). Diambil dari: ilpi.com
- Kimia Librettexts (22 Januari 2017). Struktur-Zinc Blende (ZnS). Diambil dari: chem.Libretxts.org
- Reade (2018). Sulfida sulfida/ zink (ZnS). Diambil dari: Reade.com

