Jadual Elemen Berkala
- 2614
- 430
- Dallas Bernhard
Berapakah jadual berkala unsur -unsur?
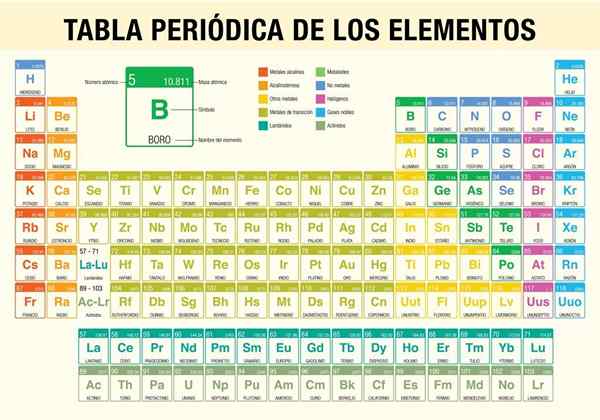
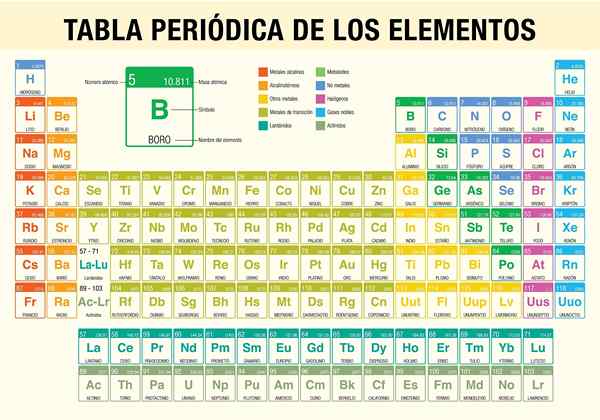
The Jadual Elemen Berkala Ia adalah alat yang membolehkan anda merujuk sifat kimia 118 elemen yang diketahui setakat ini. Ia sangat diperlukan apabila melakukan pengiraan stoikiometrik, meramalkan sifat fizikal elemen, mengklasifikasikannya, dan mencari sifat berkala di antara mereka semua.
Atom menjadi lebih berat kerana nukleus mereka menambah proton dan neutron, yang juga mesti disertai oleh elektron baru; Jika tidak, elektroneutraliti tidak mungkin. Oleh itu, sesetengah atom sangat ringan, seperti hidrogen, dan lain -lain, superpesados, seperti Oganerson.
Ia adalah saintis Dmitri Mendeléyev, yang pada tahun 1869 (hampir 150 tahun yang lalu) diterbitkan, selepas satu dekad kajian dan eksperimen teoritis, jadual berkala pertama dalam usaha untuk mengatur 62 elemen yang diketahui pada waktu itu.
Apakah jadual berkala untuk?
Kegunaan utama jadual adalah:
- Ketahui simbol dan nama setiap elemen kimia yang wujud.
- Ketahui jisim atom dan bilangan atom.
- Memaklumkan mengenai hubungan antara unsur -unsur yang berbeza.
- Tunjukkan trend yang berbeza (berkala).
- Klasifikasi jenis elemen kimia. Jenis ini termasuk logam alkali, logam asas, logam peralihan, bukan logam, gas mulia, halogen, tanah alkali, semimetal, actinid dan lanthanids.
- Meramalkan sifat elemen baru yang belum ditemui atau tidak disintesis.
Bagaimana jadual berkala diatur? (Struktur dan Organisasi)
Tempoh
Unsur -unsur diperintahkan dalam baris atau tempoh bergantung pada tahap tenaga orbitalnya. Sebelum tempoh 4, apabila unsur -unsur diikuti dalam peningkatan urutan jisim atom, bagi setiap lapan daripadanya sifat kimia diulang lagi (undang -undang oktaf, oleh John Newlands).
Logam peralihan menyelinap ke unsur -unsur bukan metallic yang lain, seperti sulfur dan fosforus. Atas sebab ini, kemasukan fizik kuantum dan konfigurasi elektronik untuk memahami jadual berkala moden adalah penting.
Orbital lapisan tenaga dipenuhi dengan elektron (dan teras proton dan neutron), kerana ia bergerak dalam tempoh. Lapisan tenaga ini berjalan seiring dengan saiz atom atau radio; Oleh itu, unsur -unsur tempoh yang lebih tinggi lebih kecil daripada yang terdapat di bawah.
H dan yang saya dapati dalam tahap tenaga pertama (tempoh); baris pertama kotak kelabu, dalam tempoh keempat; dan barisan kotak Ananjadas, dalam tempoh keenam. Perhatikan bahawa, walaupun yang terakhir kelihatan dalam tempoh kesembilan yang dikatakan, ia sebenarnya milik keenam, hanya selepas kotak kuning BA.
Kumpulan
Melawat tempoh adalah bahawa jisim, bilangan proton dan elektron meningkat. Dalam lajur atau kumpulan yang sama, walaupun jisim dan proton berbeza -beza, bilangan Elektron lapisan Valencia adalah sama.
Sebagai contoh, dalam lajur atau kumpulan pertama, H hanya mempunyai satu elektron dalam orbital 1s1, Seperti li (2s1), Natrium (3s1), Kalium (4s1) Dan sebagainya ke Francio (7s1). Nombor 1 itu menunjukkan bahawa unsur -unsur ini hampir tidak mempunyai elektron Valencia, dan oleh itu, tergolong dalam kumpulan 1 (AI). Setiap elemen berada dalam tempoh yang berbeza.
Tanpa mengira hidrogen, kotak hijau, unsur -unsur di bawahnya adalah dari kotak oren dan dipanggil logam alkali. Satu lagi ke kotak yang betul dalam mana -mana tempoh, adalah kumpulan atau lajur 2; iaitu unsur -unsurnya mempunyai dua elektron valensi.
Boleh melayani anda: prestasi teoriTetapi apabila anda bergerak ke kanan, tanpa pengetahuan tentang orbital d, anda mencapai kumpulan boro (b) atau kumpulan 13 (iiia); Bukannya kumpulan 3 (iiib) atau scandio (sc). Mengambil kira pengisian orbital d, tempoh kotak kelabu mula dilalui: logam peralihan.
Nombor Proton vs Elektron Valencia
Semasa mengkaji jadual berkala, kekeliruan boleh timbul antara nombor atom z atau bilangan jumlah proton dalam nukleus, dan jumlah elektron valensi. Sebagai contoh, karbon mempunyai z = 6, iaitu, ia mempunyai enam proton dan oleh itu enam elektron (jika tidak, ia tidak boleh menjadi atom dengan beban neutral).
Tetapi, daripada enam elektron itu, Empat dari Valencia. Atas sebab itu konfigurasi elektroniknya adalah [dia] 2s22 p2. [Dia] menandakan dua elektron 1s2 lapisan tertutup, dan secara teorinya tidak mengambil bahagian dalam pembentukan hubungan kimia.
Juga, kerana karbon mempunyai empat elektron valensi, "mudah" terletak dalam kumpulan 14 (VAT) dari jadual berkala.
Unsur -unsur di bawah karbon (ya, GE, SN, PB dan FL) mempunyai nombor atom (dan atom) yang lebih tinggi; Tetapi setiap orang mempunyai persamaan empat elektron Valencia. Ini adalah kunci kepada pemahaman mengapa elemen milik satu kumpulan dan bukan yang lain.
Unsur jadual berkala
Blok s
Seperti yang dijelaskan, kumpulan 1 dan 2 dicirikan dengan mempunyai satu atau dua elektron dalam orbital s. Orbital ini adalah geometri sfera, dan kerana mana -mana kumpulan ini turun, unsur -unsur memperoleh lapisan yang meningkatkan saiz atom mereka.
Untuk membentangkan trend yang kuat dalam sifat kimia mereka dan cara bertindak balas, unsur -unsur ini dianjurkan sebagai blok s. Oleh itu, logam alkali dan logam alkalinery tergolong dalam blok ini. Konfigurasi elektronik unsur -unsur blok ini adalah NS (1s, 2s, dll.).
Walaupun elemen helium berada di hujung kanan atas meja, konfigurasi elektroniknya adalah 1s2 Dan oleh itu milik blok ini.
Blok p
Tidak seperti blok s, unsur -unsur blok ini hadir sepenuhnya orbital penuh, sementara orbital p mereka terus mengisi dengan elektron. Konfigurasi elektronik unsur -unsur yang dimiliki oleh blok ini adalah jenis NS2Np1-6 (Orbital p boleh mempunyai satu atau sehingga enam elektron untuk diisi).
Oleh itu, di mana bahagian jadual berkala adalah blok ini? Di sebelah kanan: kotak hijau, kediaman dan biru; Iaitu unsur -unsur bukan logam dan logam berat, seperti bismut (bi) dan plumbum (pb).
Bermula dengan boron, dengan konfigurasi elektronik NS2Np1, Karbon di sebelah kanan anda menambah elektron lain: 2s22 p2. Kemudian, konfigurasi elektronik unsur -unsur lain dalam tempoh 2 blok p ialah: 2s22 p3 (nitrogen), 2s22 p4 (oksigen), 2s22 p5 (fluorida) dan 2s22 p6 (neon).
Sekiranya tempoh yang lebih rendah diturunkan, tahap tenaga 3: 3 akan mempunyai23p1-6, Dan sebagainya sehingga akhir blok p.
Perhatikan bahawa perkara yang paling penting di blok ini ialah, dari Tempoh 4, unsur -unsurnya telah sepenuhnya diisi orbital (kotak biru ke kanan). Ringkasnya: Blok S berada di sebelah kiri jadual berkala, dan blok P, di sebelah kanan.
Elemen wakil
Apakah elemen wakil? Mereka adalah orang -orang yang satu tangan dengan mudah kehilangan elektron, atau di sisi lain, mereka memenanginya untuk menyelesaikan oktet Valencia. Dengan kata lain: mereka adalah unsur -unsur blok s dan p.
Boleh melayani anda: Pengemulsi: proses emulsi, aspek molekul, aplikasiKumpulan mereka membezakan diri dari orang lain melalui huruf A pada akhirnya. Oleh itu, terdapat lapan kumpulan: dari AI ke VIIIA. Tetapi pada masa ini, sistem penomboran yang digunakan dalam jadual berkala moden adalah bahasa Arab, dari 1 hingga 18, termasuk logam peralihan.
Atas sebab itu kumpulan Boro mungkin IIIA, atau 13 (3+10); kumpulan karbon, tong atau 14; dan gas mulia, yang terakhir di sebelah kanan meja, viiia atau 18.
Logam peralihan
Logam peralihan adalah semua elemen kotak kelabu. Sepanjang tempoh mereka, orbital mereka dipenuhi, yang lima dan oleh itu boleh mempunyai sepuluh elektron. Oleh kerana sepuluh elektron perlu mengisi orbital, maka mesti ada sepuluh kumpulan atau lajur.
Setiap kumpulan ini dalam sistem penomboran lama ditetapkan dengan nombor Rom dan huruf B pada akhirnya. Kumpulan pertama, iaitu Scandio, adalah IIIb (3), besi, kobalt dan nikel VIIIB kerana mempunyai reaktiviti yang sangat serupa (8, 9 dan 10), dan zink IIB (12).
Seperti yang dapat dilihat, lebih mudah mengenali kumpulan dengan nombor Arab daripada menggunakan nombor Rom.
Logam peralihan dalaman
Dari Tempoh 6 Jadual Berkala, Orbital F mula tersedia secara bertenaga. Ini mesti diisi terlebih dahulu daripada orbital d; Dan oleh itu, unsur -unsurnya biasanya diletakkan supaya tidak melanjutkan jadual terlalu banyak.
Dua tempoh terakhir, oren dan kelabu. Terdapat tujuh orbital f, yang memerlukan empat belas elektron untuk mengisi, dan oleh itu, mesti ada empat belas kumpulan.
Jika kumpulan ini ditambah ke jadual berkala, akan ada 32 jumlah (18 + 14) dan akan mempunyai versi "memanjang":
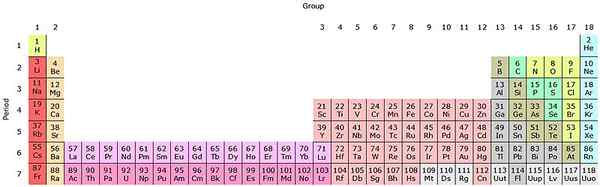 Sumber: oleh Sandbh [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
Sumber: oleh Sandbh [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Barisan merah jambu yang jelas sepadan dengan lantanoides, sementara barisan merah jambu gelap actinoids. Lantano, dengan z = 57, actinio, ac dengan z = 89, dan seluruh blok F tergolong dalam kumpulan scandio yang sama. Kerana? Kerana scandio mempunyai orbital nd1, yang terdapat di seluruh lantanoides dan actinoid.
Dan AC mempunyai tetapan Valencia 5D16s2 dan 6d17s2. Semasa anda bergerak tepat pada kedua -dua baris, orbital 4f dan 5f mula mengisi. Sekali penuh, anda mencapai unsur -unsur Luthacio, Lu, dan Laurencio, LR.
Logam dan bukan logam
Meninggalkan kek jadual berkala di belakang, lebih mudah untuk menggunakan imej yang unggul, walaupun dalam bentuknya yang panjang. Pada masa ini sebahagian besar unsur -unsur yang disebutkan di atas telah menjadi logam.
Pada suhu bilik, semua logam adalah bahan pepejal (kecuali merkuri, iaitu cecair) kelabu perak (kecuali tembaga dan emas). Mereka juga biasanya keras dan cemerlang; Walaupun blok s lembut dan rapuh. Unsur -unsur ini dicirikan oleh kemudahan kehilangan elektron dan membentuk kation m+.
Dalam kes lantanoid, tiga elektron kehilangan 5D16s2 Untuk menjadi kation trivalen m3+ (Seperti dia3+). Sementara itu, bukit dapat kehilangan empat elektron (CE4+).
Sebaliknya, unsur -unsur bukan logam membentuk sebahagian kecil daripada jadual berkala. Mereka adalah gas atau pepejal dengan atom yang berkaitan kovalen (seperti sulfur dan fosforus). Semua terletak di blok P; Lebih tepat lagi, di bahagian atasnya, seperti yang turun ke tempoh yang lebih rendah meningkatkan watak logam (BI, PB, PO).
Di samping itu, bukan logam dan bukannya kehilangan elektron, memenangi mereka. Oleh itu, mereka membentuk anion x- Dengan beban negatif yang berbeza: -1 untuk halogen (kumpulan 17), dan -2 untuk calcogens (kumpulan 16, oksigen).
Boleh melayani anda: etil alkohol: struktur, sifat, kegunaan, memperolehKeluarga logam
Di dalam logam terdapat klasifikasi dalaman untuk membezakannya dari:
- Logam Kumpulan 1 adalah alkali.
- Kumpulan 2, Logam Alkalinerrior (SR. Scholambara).
- Keluarga Kumpulan 3 (IIB) Scandio. Keluarga ini terdiri daripada Scandio, Ketua Kumpulan, Ititrium dan, dari Lantano, Actinio, dan semua Lantanoides dan Actinoides.
- Kumpulan 4 (IVB), Keluarga Titanium: Ti, Zr (Circonium), HF (Hafnio) dan RF (Rutherfordio). Berapa banyak elektron Valencia? Jawapannya ada dalam kumpulan anda.
- Kumpulan 5 (VB), Keluarga Vanadio. Kumpulan 6 (VIB), Keluarga Chrome. Dan sebagainya kepada keluarga zink, kumpulan 12 (IIB).
Metalloid
Watak logam meningkat dari kanan ke kiri, dan dari atas ke bawah. Tetapi apakah sempadan antara kedua -dua jenis elemen kimia ini? Sempadan ini terdiri daripada unsur -unsur yang dikenali sebagai metalloid, yang mempunyai ciri -ciri kedua -dua logam dan bukan logam.
Metalloid dapat dilihat dalam jadual berkala di "tangga" yang bermula dengan boron, dan berakhir dengan elemen radioaktif astato. Unsur -unsur ini adalah:
- B: Boro.
- Silikon: Ya.
- GE: Germanio.
- AS: Arsenik.
- SB: Antimoni.
- TE: Telurio.
- AT: Astato.
Setiap satu daripada tujuh elemen ini mempamerkan sifat pertengahan, yang berbeza mengikut persekitaran atau suhu kimia. Salah satu sifat ini adalah semikonduksi, iaitu, metalloid adalah semikonduktor.
Gas
Di bawah keadaan terestrial, elemen gas adalah logam bukan lampu, seperti nitrogen, oksigen dan fluorin. Juga, gas klorin, hidrogen dan mulia memasuki klasifikasi ini. Daripada mereka semua, yang paling lambang adalah gas mulia, kerana kecenderungan rendah mereka untuk bertindak balas dan berkelakuan seperti atom bebas.
Yang terakhir terdapat dalam kumpulan 18 jadual berkala dan:
- Helio, dia.
- Neon, ne.
- Argon, Ar.
- Kripton, Kr.
- Xenón, Xe.
- Radón, Rn.
- Dan yang paling baru -baru ini, gas sintetik sintetik mulia, OG.
Semua gas mulia mempunyai persamaan konfigurasi Valencia2Np6; iaitu, mereka telah menyelesaikan oktet Valencia.
Pengagregatan menyatakan kepada suhu lain
Unsur -unsur dalam keadaan pepejal, cecair atau gas bergantung pada suhu dan kekuatan interaksi mereka. Sekiranya suhu bumi sejuk sehingga sifar mutlak (0k) berada di sekitar, maka semua elemen akan membeku; Kecuali helium, yang akan memeluk.
Pada suhu yang melampau ini, seluruh gas akan berada dalam bentuk ais.
Pada yang lain melampau, jika suhu adalah kira -kira 6000k, "semua" unsur -unsur akan berada dalam keadaan gas. Di bawah syarat -syarat ini, awan emas, perak, plumbum dan logam lain boleh diperhatikan secara literal.
Kepentingan jadual berkala
Pada masa ini, jadual berkala adalah instrumen organisasi kimia yang paling penting kerana hubungan terperinci unsur -unsurnya. Penggunaannya adalah penting untuk kedua -dua pelajar dan guru dan penyelidik dan banyak profesional yang didedikasikan untuk cawangan kimia dan kejuruteraan.
Dengan hanya melihat jadual berkala, jumlah dan maklumat yang besar diperoleh dengan cepat dan berkesan, seperti:
- Lithium (li), berilium (BE) dan boron (b) Melaksanakan elektrik.
- Lithium adalah logam alkali, berilium adalah logam alkali dan boron tidak ada logam.
- Lithium adalah pemacu terbaik dari tiga bernama, diikuti oleh Beryllium dan, akhirnya, Boron (Semiconductor).
Oleh itu, dengan mencari unsur -unsur ini dalam jadual berkala, kecenderungannya terhadap kekonduksian elektrik dapat disimpulkan dengan serta -merta.