Gram pewarnaan
- 3737
- 972
- Erick Krajcik
 Pewarnaan Gram berguna untuk menggambarkan pelbagai jenis bakteria
Pewarnaan Gram berguna untuk menggambarkan pelbagai jenis bakteria Apa pewarnaan Gram?
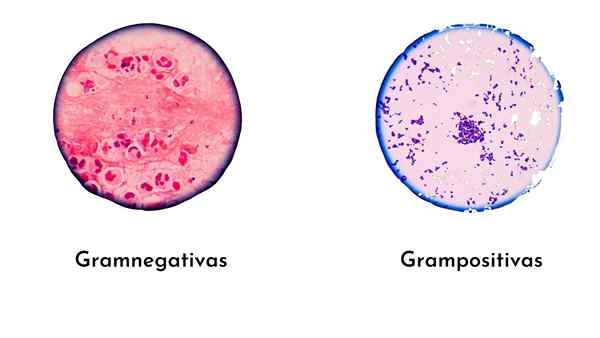
The Gram pewarnaan Ini adalah teknik pewarnaan yang paling mudah dan paling berguna dalam mikrobiologi diagnostik untuk mengenal pasti bakteria. Teknik ini dicipta oleh Doktor Denmark Christian Gram pada tahun 1884, yang mengklasifikasikan bakteria dalam gram -positif (ungu) dan gram -negative (merah jambu), menurut komposisi dinding sel.
Teknik ini mengalami pengubahsuaian tertentu oleh Hucker pada tahun 1921 untuk menstabilkan reagen dan meningkatkan kualiti pewarnaan, jadi pewarnaan Gram juga dikenali sebagai Gram-Hucker.
Dengan teknik ini juga mungkin. Serta pengedarannya di ruang angkasa: dalam kelompok, dalam rantai, terpencil, berpasangan, dalam tetrad, dll.
Asas
Ini adalah teknik yang membentangkan 4 langkah asas: pewarnaan, penetapan dengan mordan, perubahan warna dan pengambilan pekerja. Oleh itu, sebagai tambahan kepada bakteria pewarna, ia juga membolehkan anda membezakannya.
Violet Crystal adalah pewarna pertama yang digunakan. Begitu juga dengan peptidoglycan dan akan mewarnai semua bakteria yang hadir, kemudian meletakkan lugol, yang bertindak sebagai mordan, iaitu, ia akan mendorong pembentukan kompleks tidak larut kaca violet/yodium/ribonuklear di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel di dalam sel.
Bakteria gram -positif, mempunyai dinding peptidoglycan tebal, membentuk lebih kompleks (kaca violet/iodin), oleh itu, mereka akan dicelup ungu.
Ia juga mempengaruhi bahawa dinding bakteria gram -positif mengandungi lebih banyak asid yang tidak terkawal, yang menunjukkan pertalian yang besar untuk agen pengoksidaan (Lugol).
Bakteria Gram -negatif mempunyai tanjung peptidoglycan yang nipis, yang menjadikan bakteria terbentuk kurang kompleks daripada gram -positif.
Seterusnya datang langkah perubahan warna, di mana bakteria gram -positif dan gram -negatif berkelakuan berbeza.
Bakteria Gram -negatif mengandungi membran luar yang kaya dengan lipopolysaccharides yang merupakan sebahagian daripada dinding selnya. Lemak dimusnahkan dengan bersentuhan dengan alkohol aseton, jadi membran luaran tidak stabil, kaca violet dibebaskan.
Ini adalah bagaimana ia kemudian diupah dengan safranin asas atau fuchsin, mengambil warna merah.
Dalam kes bakteria gram -positif, mereka menentang perubahan warna kerana peluntur bertindak dengan menutup liang -liang, yang menghalang kompleks kristal violet/iodin daripada dapat keluar.
Oleh itu, pewarna dengan kaca violet stabil, dan tidak ada tempat untuk safranine atau fuchsin. Oleh itu, bakteria ini dicelupkan sengit atau ungu.
Bahan
Set pewarnaan Gram terdiri daripada:
- Kaca Violet.
- Lugol.
- Alkohol aseton.
- Safranin asas atau fuchsin.
Penyediaan pewarna dan reagen
Penyelesaian Kristal Violet
Penyelesaian untuk:
Violet Crystal - 2 gr
95% - 20 cc etil alkohol
Penyelesaian b:
Ammonium oxalate - 0.8 gr
Air sulingan- 80 cc
Untuk penyediaan akhir kaca violet, penyelesaian kepada 1:10 mesti dicairkan dengan air suling dan campurkan dengan 4 bahagian penyelesaian b. Campuran disimpan selama 24 jam sebelum menggunakannya. Ia ditapis ke dalam botol pewarnaan ambar menggunakan penapis kertas.
Ia boleh melayani anda: Chiapas Flora dan Fauna: Spesies PerwakilanJumlah yang digunakan setiap hari dipindahkan ke botol amber dengan penitis.
Iodine-Lugol
Timbang dan mengukur jumlah yang ditunjukkan setiap kompaun, seperti berikut:
Kristal iodin - 1 gr
Potassium Ioduro - 2 gr
Air sulingan - 300 cc
Iodida kalium dibubarkan sedikit demi sedikit di dalam air dan seterusnya iodin ditambah. Penyelesaian kepada botol amber dipindahkan.
Jumlah yang digunakan setiap hari dipindahkan ke botol amber yang lebih kecil dengan penitis.
Peninggalan
95% etil alkohol - 50 ml
Acetone - 50 ml
Ia disediakan di bahagian yang sama. Tutup dengan baik, kerana ia cenderung menguap.
Bottero di Fut.
Penyediaan ini menyediakan perubahan warna masa yang sederhana 5-10 saat., Dan ia adalah yang paling disyorkan.
Beginters lebih suka menggunakan hanya 95%etil alkohol, di mana perubahan warna lebih perlahan, dari 10 hingga 30 saat.
Walaupun yang paling berpengalaman boleh menggunakan aseton tulen, di mana perubahan warna berlaku dengan cepat dari 1 hingga 5 saat.
Kontras
Penyelesaian Ibu Safranine
Safranine - 2.5 gr
95%etil alkohol - 100 cc
Setelah menimbang jumlah safranin yang ditunjukkan, ia larut pada 100 cc etil alkohol pada 95%.
Dari penyelesaian ibu, penyelesaian safranin kerja disediakan.
Untuk melakukan ini, ukur 10 cc penyelesaian ibu, tambahkan 90 cc air suling untuk menyelesaikan 100 ml.
Disyorkan untuk memindahkan jumlah yang digunakan setiap hari ke botol amber dengan dripper.
Mikroorganisma yang dicelup lemah dengan pewarnaan gram-hucker, seperti anaerob tertentu, Legionella SP, Campylobacter SP dan Brucella sp, Mereka boleh bernoda lebih baik jika pengubahsuaian yang dibuat oleh Kopeloff ke pewarnaan Gram-hucker, yang dipanggil Gram-Kopeloff Pewarnaan Made.
Teknik ini mengubah pewarna safranin untuk fuchsin asas. Dengan pengubahsuaian ini, adalah mungkin untuk mewarnai mikroorganisma yang disebutkan di atas.
Penyimpanan reagen
Pewarna yang disediakan mesti disimpan pada suhu bilik.
Penyediaan sampel lanjutan ke pewarna
Sampel mesti mengandungi sekurang -kurangnya 105 mikroorganisma sebelum pemerhatiannya mungkin berlaku. Yang dilanjutkan dapat dijalankan dari sampel langsung atau tanaman dalam media pepejal atau cair.
Yang dilanjutkan mestilah seragam, diedarkan dengan baik dan tidak terlalu tebal, untuk visualisasi yang lebih baik dari struktur yang hadir.
Gram sampel langsung
Gram air kencing tanpa sentrifugasi
Air kencing bercampur dan 10 μl diletakkan pada slaid. Pemerhatian sekurang -kurangnya satu medan bakteria/rendaman menunjukkan bahawa terdapat jangkitan.
Ini bermaksud bahawa tanaman akan mempunyai lebih kurang 100.000 UFC/ml (105 UFC/ml) air kencing dalam 85% kes.
Kaedah ini tidak berguna untuk tuduhan penjajah di bawah 100.000 UFC.
Gram CSF
CSF mestilah sentrifuge, supernatan dikeluarkan dan sedimen meluas dalam slaid. Cecair ini steril dalam keadaan normal. Pemerhatian bakteria menunjukkan jangkitan.
Boleh melayani anda: kelenjar garamGram sampel pernafasan
Basuh gram, bronkial atau broncoalveolar, walaupun terdapat pelbagai mikroorganisma, ia akan sentiasa membimbing diagnosis, selain berguna jenis sel yang diperhatikan.
Dalam kes Esputo, yang dilanjutkan dengan bahagian sampel yang paling purulen mesti disediakan.
FECES Gram
Tidak dinasihatkan untuk membuat gram untuk jenis sampel ini, kerana ia tidak mempunyai nilai diagnostik.
Gram tanaman
Mereka boleh dilakukan dalam dua cara, satu dari tanaman cecair dan satu lagi dari tanaman pepejal.
Tanaman cecair
Dari tanaman cecair, sangat mudah: di bawah lebih ringan beberapa panggang sup keruh diambil dan diletakkan pada slaid yang bersih dan kering, memberikan pergerakan bulat dari pusat ke pinggir, untuk mengedarkan bahan secara merata.
Ia dibenarkan secara spontan ke udara. Sekali kering, bahan itu tetap ke lembaran dengan haba. Untuk melakukan ini, dengan bantuan pengapit anda lulus lembaran 3 hingga 4 kali melalui api Bunsen lebih ringan, berhati -hati untuk tidak membakar bahan.
Lembaran dibenarkan untuk menyejukkan dan diletakkan di atas jambatan pewarnaan.
Tanaman pepejal
Untuk melaksanakan pewarnaan gram yang dilanjutkan dari tanaman pepejal, teruskan seperti berikut:
Sebelum memilih koloni untuk diambil, anda mesti menyediakan kambing slot, meletakkan kira -kira dua titisan garam fisiologi steril.
Sekiranya plat penanaman asal mengandungi beberapa jenis koloni yang berbeza, koloni terpencil masing -masing akan dipilih untuk melaksanakan gram. Setiap koloni akan diambil dengan pemegang platinum untuk membubarkannya dalam larutan garam yang diletakkan sebelum ini di slaid.
Pergerakan bulat diberikan dari pusat ke pinggir, untuk mengedarkan koloni secara homogen di slaid.
Ia dibenarkan secara spontan ke udara. Sekali kering, lembaran itu ditetapkan dengan haba, seperti yang dijelaskan di atas (menyala slot slot dengan lebih ringan), berhati -hati untuk tidak membakar bahan.
Prosedur ini mesti dijalankan dengan setiap jenis koloni yang berlainan. Perintah apa yang diperhatikan, sebagai contoh:
Colonia 1: Betahemolytic Yellow Colonia: Gram -Positif Kelapa diperhatikan dalam kelompok.
Colonia 2: Colly Colonia, Tanpa Hemolisis: Gramnegative Cocobacilli diperhatikan.
Setiap helaian mesti dilabel untuk mengetahui apa yang kita perhatikan.
Teknik
Teknik pewarnaan Gram sangat mudah dilakukan dan agak ekonomi, dan tidak dapat hilang di makmal mikrobiologi.
Ia dilakukan seperti berikut:
- Tetapkan smear dengan panas dan letakkan di jambatan pewarna.
- Lembaran itu ditutup sepenuhnya dengan kaca violet dengan 1 minit.
- Basuh dengan air. Jangan kering.
- Tutup lembaran dengan penyelesaian Lugol, biarkan bertindak selama 1 minit. Basuh dengan air. Jangan kering.
- Hiaskan 5-10 saat dengan pergolakan lembut dalam alkohol aseton. O Letakkan lembaran secara menegak dan jatuhkan titisan di permukaan sehingga ia menyeret ganti kristal violet. Jangan melebihi.
- Basuh dengan air. Jangan kering.
- Letakkan lembaran di jambatan pewarna dan tutup sebanyak 30 saat dengan safranine (gram-hucker) atau 1 min dengan asas fuchsina (gram-kopeloff).
- Basuh dengan air.
- Biarkan secara spontan di udara dalam kedudukan menegak.
Setelah kering, letakkan 1 setitik minyak rendaman untuk memerhatikannya di bawah sasaran 100x dalam mikroskop optik.
Penggunaan/aplikasi pewarnaan gram
- Teknik ini membolehkan untuk membezakan perbezaan morfotintorial kebanyakan bakteria.
- Ragi juga dibezakan dengan pewarnaan ini. Mereka mengambil kaca violet, iaitu, mereka dicelup gram -positif.
- Anda boleh membezakan bacilli spora gram, di mana ruang yang jelas diperhatikan di dalam bacillus di mana endospora terbentuk, walaupun spora tidak bernoda dengan baik. Untuk mencelupkan spora teknik lain digunakan, seperti Shaeffer-Fulton.
- Membantu menentukan jenis antibiotik yang mesti disediakan.
Harus diperhatikan bahawa pewarnaan ini Ia tidak berfungsi Untuk mewarnai semua jenis bakteria, iaitu, ada kes di mana pewarnaan tidak berfungsi.
Dalam kes ini, bakteria yang kekurangan dinding sel dapat disebutkan. Contohnya: jantina Mycoplasma, Spheroplast, Ureaplasma, L bentuk dan protoplas.
Di samping itu, bakteria dengan bakteria kaya dengan asid mycolic, seperti mycobacteria, dan bakteria intrasel, seperti chlamydias dan rickettsias.
Ia juga tidak berkesan untuk mewarnai kebanyakan bakteria spirokim.
Terdapat bakteria genus yang sama yang dapat diperhatikan dalam sampel yang sama seperti gram -positive dan sebagai gram -negative. Apabila ini berlaku, ia dipanggil pewarnaan gram berubah -ubah, yang mungkin disebabkan oleh perubahan nutrien, suhu, pH atau kepekatan elektrolit.
Kesalahan biasa
Hiaskan secara berlebihan
Membesar -besarkan dalam pas perubahan warna boleh menyebabkan pemerhatian mikroorganisma negatif gram palsu.
Jangan tunggu masa pengeringan yang cukup untuk menambah minyak rendaman
Kesalahan ini menyebabkan micel lemak membentuk yang menghalang pemerhatian struktur yang ada. Ini berlaku apabila minyak menyertai molekul air yang terdapat dalam bau.
Melabur perintah reagen
Kesalahan seperti ini akan menghasilkan bakteria negatif gram untuk digambarkan, iaitu gram palsu -positif.
Gunakan tanaman lama (pepejal atau cecair)
Ia boleh menyebabkan bakteria gram -positif menjadi noda gram -negatif (gram -negative false). Ini berlaku kerana di tanaman lama kemungkinan besar ada bakteria mati atau merosot, dan di bawah keadaan ini bakteria tidak mengekalkan kaca violet.
Gunakan penyelesaian Lugol yang sangat lama
Dari masa ke masa, Lugol kehilangan sifatnya dan warnanya pudar. Sekiranya reagen yang telah degenerasi digunakan, ini tidak akan membetulkan kaca violet dengan baik, oleh itu terdapat kemungkinan mendapatkan visualisasi mikroorganisma negatif gram palsu.
Latar belakang biru
Latar belakang warna yang betul akan berwarna merah. Latar belakang biru menunjukkan bahawa perubahan warna tidak mencukupi.
Rujukan
- Rumah-Rincón, g. (1994). Mycology Umum. Universiti Pusat Venezuela.
- Gram pewarnaan. Diambil daripadanya.Wikipedia.org.
- González, m., González, n. (2011). Manual Mikrobiologi Perubatan. Direktorat Media dan Penerbitan Universiti Carabobo.

