Jenis bateri, ciri dan reaksi

- 2302
- 622
- Anthony Breitenberg
Di pasaran anda boleh menjadi berbeza Jenis bateri dengan karakteristiknya sendiri. Bateri, yang tidak lebih daripada sel voltan, memberikan pengguna kelebihan mengambil dengan mana -mana tempat (dengan syarat keadaan tidak drastik).
Secara amnya bateri boleh dibeli terpencil; Tetapi, mereka juga melekat antara satu sama lain dalam siri atau selari, yang ditetapkan adalah apa yang mereka panggil bateri. Dan kadang -kadang istilah 'bateri' dan 'bateri' biasanya digunakan secara tidak sengaja, walaupun mereka tidak sama.
 Bateri Alkali: Salah satu jenis bateri yang paling terkenal
Bateri Alkali: Salah satu jenis bateri yang paling terkenal Bateri boleh mempunyai warna, bentuk dan saiz yang tak terhitung jumlahnya, seperti yang boleh dibuat dari bahan lain. Juga, dan lebih penting lagi, struktur dalaman mereka, di mana tindak balas kimia yang menjana elektrik dibangunkan, berfungsi untuk membezakannya antara satu sama lain.
Contohnya, tiga bateri alkali, salah satu yang paling biasa ditunjukkan pada gambar atas. Istilah alkali merujuk kepada fakta bahawa medium di mana pelepasan dan aliran elektron berlaku adalah asas; iaitu, ia mempunyai pH lebih besar daripada 7 dan anion oh mendominasi- dan caj negatif lain.
[TOC]
Klasifikasi Pilas
Sebelum menangani beberapa jenis bateri yang berlainan, perlu mengetahui bahawa ini diklasifikasikan secara global sebagai primer atau menengah.
- Bateri utama
Bateri utama adalah yang pernah dimakan, mesti dibuang atau dikitar semula, kerana tindak balas kimia di mana arus elektrik dikekalkan tidak dapat dipulihkan. Oleh itu, ini tidak dapat dicas semula.
Mereka terutamanya digunakan dalam aplikasi di mana ia tidak praktikal untuk mengisi semula tenaga elektrik; seperti pada peranti ketenteraan, di tengah -tengah medan perang. Mereka juga direka untuk peralatan yang mengambil sedikit tenaga, sehingga mereka bertahan lebih lama; Sebagai contoh, kawalan jauh atau konsol mudah alih (Gameboy, Tetris dan Tamagotchi).
Bateri Alkali, untuk memetik contoh lain, juga tergolong dalam jenis utama. Mereka biasanya mempunyai bentuk silinder, walaupun ini tidak menyiratkan bahawa bateri silinder tidak boleh menengah atau boleh dicas.
- Bateri sekunder
Tidak seperti bateri utama, yang menengah boleh dicas semula apabila mereka kehabisan tenaga.
Ini kerana tindak balas kimia yang berlaku di dalamnya boleh diterbalikkan, dan oleh itu, selepas menggunakan voltan tertentu, ia menyebabkan spesies produk menjadi reagen lagi, untuk memulakan reaksi lagi.
Beberapa bateri sekunder (dipanggil bateri) biasanya kecil, seperti yang utama; Walau bagaimanapun, mereka diperuntukkan kepada peranti yang menggunakan lebih banyak tenaga dan yang mana penggunaan bateri utama akan menjadi ekonomi dan bertenaga. Contohnya, bateri telefon bimbit mengandungi bateri sekunder.
Juga, bateri sekunder direka untuk peralatan atau litar yang besar; Sebagai contoh, bateri kereta, yang terdiri daripada beberapa bateri atau sel voltan.
Mereka biasanya lebih mahal daripada bateri dan bateri utama, tetapi untuk kegunaan panjang mereka akhirnya menjadi pilihan yang lebih sesuai dan berkesan.
- Aspek lain
Bateri diklasifikasikan sama ada dalam primer atau sekunder; Tetapi secara komersil atau popular, mereka biasanya diklasifikasikan mengikut bentuk (silinder, segi empat tepat, butang), ke peranti yang ditakdirkan (kamera, kenderaan, kalkulator), kepada nama mereka (AA, AAA, C, D, N, A23, dll dan lain -lain .), Dan kod IEC dan ANSInya.
Ia boleh melayani anda: piridin: struktur, sifat, kegunaan, ketoksikan, sintesisJuga, ciri -ciri seperti voltannya (1.2 hingga 12 volt), serta kehidupan dan harga berguna mereka, bertanggungjawab untuk memberikan klasifikasi tertentu di mata pengguna.
Senarai jenis longgokan
- Bateri karbon-zink
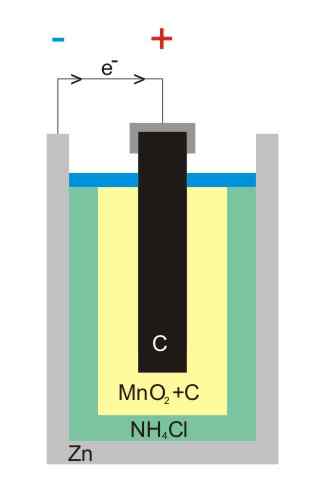 Ilustrasi bateri zink-karbon
Ilustrasi bateri zink-karbon Bateri karbon-zink (juga dikenali sebagai sel Leclanché atau Salinas pilas) adalah salah satu yang paling primitif, dan kini dianggap hampir tidak digunakan di hadapan bateri lain; Terutamanya, di hadapan bateri alkali, yang walaupun mereka sedikit lebih mahal, mereka mempunyai masa hidup dan voltan utama.
Seperti namanya, elektrodnya terdiri daripada tin zink dan batang grafit, sepadan dengan anod dan katod, masing -masing.
Dalam elektrod pertama, anod berasal dari elektron dengan pengoksidaan zink logam. Elektron ini kemudian mengembara litar luaran yang memakan peranti dengan elektrik, dan kemudian berakhir di katod grafit, di mana kitaran selesai apabila dioksida mangan dikurangkan di mana ia terendam.
Reaksi
Persamaan kimia untuk tindak balas yang berlaku di elektrod adalah:
Zn (s) → Zn2+(Ac) + 2e- (Anod)
2 mno2(s) + 2e- + 2 nh4Cl (ac) → mn2Sama ada3(s) + 2 nh3(Ac) + h2Atau (l) + 2 cl- (Ac) (katod)
Bateri ini sangat serupa dengan alkali: kedua -duanya adalah silinder (seperti imej). Walau bagaimanapun, bateri karbon-zink boleh dibezakan jika ciri-ciri yang dilabel di luar negara dibaca secara terperinci, atau jika kod IEC anda didahului oleh huruf r r r. Voltannya ialah 1.5 V.
- Bateri alkali
Bateri alkali sangat serupa dengan jenis karbon-zink, dengan perbezaan medium di mana elektrod mengandungi anion oh-. Medium ini terdiri daripada elektrolit kuat kalium hidroksida, KOH, yang menyumbang OH- yang mengambil bahagian dan "bekerjasama" dalam penghijrahan elektron.
Ia datang dalam pelbagai saiz dan voltan, walaupun yang paling biasa ialah 1.5V. Mereka mungkin bateri paling terkenal di pasaran (Duracell, sebagai contoh).
Reaksi yang berlaku di elektrod mereka adalah:
Zn (s) + 2OH-(aq) → ZnO (s) + h2Atau (l) + 2e- (Anod)
2mn2(s) + h2Atau (l) + 2e- → Mn2Sama ada3(s) + 2OH-(aq) (katod)
Apabila suhu meningkat, tindak balas berlaku lebih cepat dan lebih cepat bateri dilepaskan. Menariknya, khabar angin popular berlari untuk meletakkannya di dalam peti sejuk untuk meningkatkan masa hidup mereka; Tetapi, apabila penyejukan, kandungannya mungkin mengalami kemungkinan penyusunan yang membawa kecacatan atau risiko lebih lanjut dengan mereka.
Mercury
 Bateri merkuri yang mungkin, yang boleh dikelirukan dengan bateri oksida perak. Sumber: Multicherry [CC0].
Bateri merkuri yang mungkin, yang boleh dikelirukan dengan bateri oksida perak. Sumber: Multicherry [CC0]. Bateri Mercury sangat ciri kerana rasa malu perak mereka (imej unggul). Hampir semua orang akan mengenali mereka pada pandangan pertama. Mereka juga alkali, tetapi katod mereka menggabungkan, sebagai tambahan kepada grafit dan mangan dioksida, merkuri oksida, HGO; yang, selepas mengurangkan, menjadi merkuri logam:
Zn (s) + 2OH-(Ac) → ZnO (s) + h2Atau (l) + 2e-
HGO (s) + h2O + 2E- → Hg (s) + 2OH-
Boleh melayani anda: magnesium oksida: struktur, sifat, tatanama, kegunaanPerhatikan bagaimana dalam reaksi sel ini anion OH dimakan dan diperbaharui-.
Menjadi bateri kecil, ia bertujuan untuk artifak kecil, seperti jam tangan, kalkulator, kawalan mainan, dll. Yang telah menggunakan mana -mana objek ini akan menyedari bahawa tidak perlu mengubah bateri untuk hampir "keabadian"; yang berumur 10 tahun, lebih kurang.
Silver Oxide
 Bateri oksida perak. Sumber: Lukas A, CZE [Domain Awam].
Bateri oksida perak. Sumber: Lukas A, CZE [Domain Awam]. Kecacatan utama bateri merkuri ialah apabila mereka dibuang, mereka mewakili masalah yang serius untuk alam sekitar, kerana ciri -ciri toksik logam tersebut. Mungkin ini kekurangan kod IEC dan ANSI. Untuk bateri oksida perak, kod IEC didahului oleh huruf s.
Salah satu pengganti bateri merkuri sepadan dengan oksida perak, jauh lebih mahal, tetapi kurang kesan ekologi (imej unggul). Pada permulaannya, mereka mengandungi merkuri untuk melindungi zink dari kakisan alkali.
Ia boleh didapati dengan voltan 1.5V, dan aplikasinya sangat mirip dengan Pila Mercury. Malah, pada pandangan pertama kedua -dua bateri kelihatan sama; Walaupun mungkin ada bateri oksida perak yang lebih besar.
Reaksi dalam elektrod mereka adalah:
Zn (s) + 2OH-(Ac) → Zn (OH)2(s) + 2 e-
Ag2Atau (s) + 2h+(Ac) + 2e- → 2AG (s) + h2Atau (l)
Air kemudiannya menderita elektrolisis, mengurai pada ion H+ Dan oh-.
Perhatikan bahawa bukannya merkuri, ia terbentuk dalam katod perak logam.
- Nickel-Cadmium Pilas (Nicad)
 Bateri NICD. Sumber: Lordider [CC0].
Bateri NICD. Sumber: Lordider [CC0]. Dari titik ini, bateri sekunder atau bateri dipertimbangkan. Seperti Mercury, bateri nikel-kadmium berbahaya kepada alam sekitar (untuk fauna dan kesihatan) oleh kadmium logam.
Mereka dicirikan dengan menghasilkan arus elektrik yang tinggi dan sebilangan besar kali dapat diisi semula. Malah, 2000 kali boleh dicas semula, yang sama dengan ketahanan yang luar biasa.
Elektrodnya terdiri daripada nikel oksida hidroksida, kanak -kanak (OH), untuk katod, dan kadmium logam untuk anod. Yayasan Kimia, pada dasarnya, tetap sama: kadmium (bukan zink) kehilangan elektron, dan Cadmium Nio (OH) memenangi mereka.
Reaksi semikelled adalah:
CD (s) + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (OH) (s) + 2h2Atau (l) + 2e- → 2ni (oh)2(s) + oh-(Ac)
Oh anion-, Sekali lagi, mereka datang dari elektrolit KOH. Bateri Nicad, kemudian, akhirnya menjana hidroksida logam nikel dan kadmium.
Ia digunakan secara individu atau ditambah dalam pakej (seperti imej kuning, unggul). Mereka datang, kemudian, dalam pakej besar atau kecil. Anak -anak kecil mencari penggunaan dalam mainan; Tetapi yang besar, ditakdirkan untuk pesawat dan kenderaan elektrik.
- Nickel-Hydro Metallic Pilas (NI-HM)
 Bateri Ni-Hm. Sumber: Ramsh Ng of Flickr (https: // www.Flickr.com/foto/rameshng/5645036051)
Bateri Ni-Hm. Sumber: Ramsh Ng of Flickr (https: // www.Flickr.com/foto/rameshng/5645036051) Satu lagi bateri atau bateri yang terkenal, dan yang melebihi kapasiti tenaga Nicad, adalah Ni-HM (nikel dan hidrida logam). Ia boleh datang dalam format silinder (bateri konvensional, imej unggul), atau ditambah dengan bateri.
Kimia hadir hampir ciri -ciri yang sama seperti bateri Nicad, dengan perbezaan utama berdasarkan elektrod negatifnya: katod bukan kadmium, tetapi aloi intermetallic nadir bumi dan logam peralihan.
Boleh melayani anda: pengering putar: operasi, apa itu, bahagian, aplikasiAloi ini bertanggungjawab untuk menyerap hidrogen yang dibentuk semasa beban, menghasilkan hidrida logam kompleks (oleh itu huruf H dalam namanya).
Walaupun bateri Ni-HM memberikan lebih banyak tenaga (kira-kira 40% lebih), lebih mahal, mereka memakai lebih cepat, dan tidak boleh dimuat semula pada masa yang sama seperti bateri Nicad; iaitu, mereka mempunyai masa hidup yang lebih rendah. Walau bagaimanapun, mereka tidak mempunyai kesan memori (kehilangan prestasi bateri dengan tidak sepenuhnya dilepaskan).
Oleh sebab itu, mereka tidak boleh digunakan dalam jentera yang bekerja dalam jangka panjang; Walaupun masalah ini telah dibungkus dengan bateri LSD-NIHM. Begitu juga, bateri atau bateri Ni-Hm mempunyai ciri-ciri terma yang sangat stabil, yang boleh dikendalikan dalam pelbagai suhu tanpa mewakili risiko.
Reaksi
Reaksi yang berlaku di elektrod mereka adalah:
Ni (oh)2(s)+ oh-(ac) ⇌ nio (OH) (s) + h2Atau (l) + e-
H2Atau (l) + m (s) + e- ⇌ Oh-(ac)+ mh (s)
- Bateri ion-litio
 Bateri lithium-ion komputer riba. Sumber: Kristoferb dari Wikipedia.
Bateri lithium-ion komputer riba. Sumber: Kristoferb dari Wikipedia. Di bateri dan bateri lithium mereka berdasarkan penghijrahan ion li+, yang dipindahkan dari anod ke katod, produk penolakan elektrostatik oleh caj positif yang semakin meningkat.
Ada yang boleh mengisi semula, seperti bateri komputer riba (imej unggul), dan lain -lain, silinder dan segi empat tepat (licin2, Lisocl2 atau limo2) Tidak.
Bateri ion-litio dicirikan dengan menjadi sangat ringan dan tenaga, yang membolehkan mereka digunakan dalam banyak peranti elektronik, seperti telefon pintar dan peralatan perubatan. Mereka juga menderita hampir dari kesan ingatan, ketumpatan beban mereka melebihi bateri dan bateri Nicad dan Ni-Hm, dan melambatkan lebih banyak dalam memuat turun.
Walau bagaimanapun, mereka sangat sensitif terhadap suhu tinggi, walaupun meletup; Dan di samping itu, mereka biasanya lebih mahal di hadapan bateri lain. Walaupun begitu, di bateri lithium pasaran dilihat dengan mata yang baik, dan banyak pengguna memenuhi syarat mereka sebagai yang terbaik.
- Bateri plumbum asid
 Bateri Bateri Carf Carf Tipikal. Sumber: tntflash [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Bateri Bateri Carf Carf Tipikal. Sumber: tntflash [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Dan akhirnya, bakteria plumbum asid, seperti namanya, tidak mengandungi ion oh- tetapi h+; Khususnya, larutan asid sulfurik pekat. Sel voltan berada di dalam kotak mereka (imej atas), di mana tiga atau enam daripadanya boleh ditambah dalam siri, memberikan bateri 6 atau 12 V, masing -masing.
Ia dapat menjana sejumlah besar caj elektrik, dan kerana mereka sangat berat, mereka ditakdirkan untuk aplikasi atau peranti yang tidak dapat diangkut secara manual; Sebagai contoh, kereta, panel solar dan kapal selam. Bateri asid ini adalah yang tertua dan masih berkuatkuasa dalam industri automotif.
Elektrod anda diperbuat daripada plumbum: PBO2 Untuk katod, dan memimpin logam spongy untuk anod. Reaksi yang berlaku di dalamnya adalah:
PB (s) +HSO-4(aq) → PBSO4(s) +h+(aq) + 2e-
Pbo2(s) +HSO-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2Atau (l)
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Odunlade Emmanuel. (24 Julai 2018). Pelbagai jenis bateri dan pelupusan. Circuit Digest. Pulih dari: circuitdigest.com
- PRBA. (s.F.). Jenis bateri. Pulih dari: PRBA.org
- Isidor Buchman. (2019). Apa bateri terbaik? Bateri Universiti. Diperolehi dari: BateriUniversity.com
- Syarikat McGraw-Hill. (2007). Bab 12: Bateri. [Pdf]. Pulih dari: Oakton.Edu
- Shapley Patricia. (2012). Jenis bateri biasa. Universiti Illinois. Pulih dari: butana.Chem.Uiuc.Edu
- Sikap ekologi. (22 Januari 2017). Jenis Bateri: Panduan Lengkap dengan Bateri dan Bateri yang Ada. Diperolehi daripada: ekkologi.com
- « Biografi Tomás Mejía, kerjaya ketenteraan, menembak
- Asid anhydrides Bagaimana terbentuk, aplikasi dan contoh »

