Asid anhydrides Bagaimana terbentuk, aplikasi dan contoh

- 1065
- 230
- Ms. Santos Fritsch
The asid anhydrides Mereka dianggap sangat penting di antara pelbagai sebatian asal organik yang wujud. Ini dibentangkan sebagai molekul yang mempunyai dua kumpulan asid (substituen organik yang formulanya adalah RCO-, di mana r adalah rantai karbon) bersatu dengan atom oksigen yang sama.
Terdapat juga kelas anhydrides asid yang biasanya dijumpai: anhydrides karboksilik, dipanggil kerana asid permulaan adalah asid karboksilik. Untuk menamakan orang -orang jenis ini yang strukturnya simetri, hanya penggantian istilah yang mesti dibuat.

Ekspresi asid mesti diganti dalam tatanama asid karboksilik asalnya dengan istilah anhydride, yang bermaksud "tanpa air", tanpa mengubah sisa nama molekul yang terbentuk. Sebatian ini juga boleh dihasilkan berdasarkan satu atau dua kumpulan asid dari asid organik lain, seperti asid fosfonik atau asid sulfonik.
Begitu juga, anhidrida asid boleh disebabkan oleh asid tak organik, seperti asid fosforik. Walau bagaimanapun, sifat fizikal dan kimianya, aplikasinya dan ciri -ciri lain bergantung kepada sintesis yang dijalankan dan struktur anhydride.
[TOC]
Bagaimana anhidrida berasid terbentuk?
Beberapa asid anhydrides berasal dari pelbagai cara, sama ada di makmal atau dalam industri. Dalam sintesis perindustrian, anhidrida asetik diambil sebagai contoh, yang kebanyakannya dihasilkan oleh proses karbonilasi molekul metil asetat.
Satu lagi contoh sintesis ini ialah anhidrida maleico, yang dihasilkan melalui pengoksidaan molekul benzena atau butana.
Ia boleh melayani anda: zink hidroksida (Zn (OH) 2)Walau bagaimanapun, dalam sintesis asid anihidrida di makmal, penekanan diletakkan pada dehidrasi asid yang sepadan, seperti pengeluaran anhidrida etanik, di mana dua molekul asid etian dehidrasi dehidrasi untuk menimbulkan rampasan yang disebutkan.
Dehidrasi intramolekul juga boleh berlaku; Iaitu, dalam molekul yang sama asid dengan dua kumpulan karboksil (atau dicarboxylic), tetapi jika bertentangan berlaku dan asid anhidrida mengalami hidrolisis, regenerasi asid yang berasal, ia berlaku berlaku,.
Anhydrides asid yang substituen acilnya sama, manakala dalam anhydrids jenis ini dianggap bercampur -campur molekul ini berbeza adalah berbeza.
Walau bagaimanapun, spesies ini juga dihasilkan apabila tindak balas berlaku di antara asid halur (formula umumnya adalah (RCOX)) dengan molekul karboksilat (yang formula umumnya adalah r'COOO-)))))))). [2]
Formula Umum
Formula umum anhydrides asid adalah (RC (O))2Atau, yang lebih baik diperhatikan dalam imej yang diletakkan pada permulaan artikel ini.
Contohnya, untuk anhidrida asetik (dari asid asetik) formula umum adalah (CH3Co)2Atau, menulis sama untuk banyak anhidrida asid yang serupa.
Seperti yang dinyatakan di atas, sebatian ini mempunyai nama yang sama dengan asid prekursor mereka, dan satu -satunya perkara yang berubah adalah asid istilah oleh anhidrida, kerana peraturan yang sama penomboran atom dan substituen mesti diikuti untuk berjaya dengan tatanama mereka.
Aplikasi
Anhydrides Asid mempunyai banyak fungsi atau aplikasi bergantung pada medan yang sedang dikaji, kerana mereka mempunyai kereaktifan yang tinggi, mereka boleh menjadi reagen prekursor atau menjadi sebahagian daripada banyak reaksi penting.
Boleh melayani anda: pirolisisContohnya ialah industri, di mana anhidrida asetik dihasilkan dalam kuantiti yang banyak kerana ia adalah struktur paling mudah yang dapat diasingkan. Anhydride ini digunakan sebagai reagen organik yang penting, seperti ester asetat.
Penggunaan Perindustrian
Sebaliknya, anhidrida maleico ditunjukkan dengan struktur kitaran, yang digunakan dalam pengeluaran liputan untuk kegunaan perindustrian dan sebagai pendahulu beberapa resin melalui proses kopolimeter dengan molekul stretus. Di samping itu, bahan ini berfungsi sebagai dienophile apabila reaksi diels-alder dijalankan.
Begitu juga, terdapat sebatian yang mempunyai dua molekul anhidrid asid dalam struktur mereka, seperti ethystarboxylic atau dianhydride dianhydrid.
Di samping itu, terdapat anhydride bercampur yang dipanggil 3'-phosphoadenosín-5'-phosphosulfate, dari asid fosforik dan sulfurik, yang merupakan koenzim yang paling biasa dalam reaksi pemindahan sulfat biologi.
Contoh anhydrides asid
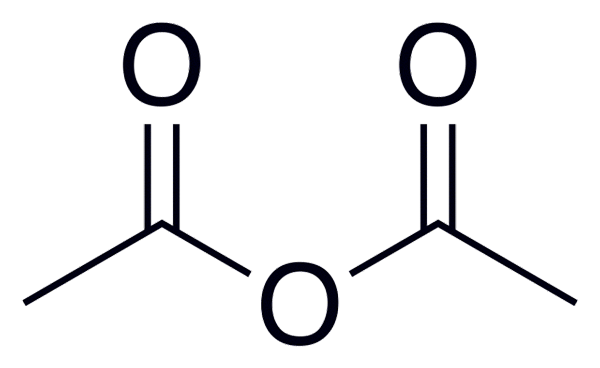 Anhydride asetik
Anhydride asetik Berikut adalah senarai dengan nama -nama beberapa anhidrida asid, untuk memberikan beberapa contoh sebatian penting dalam kimia organik yang boleh membentuk sebatian struktur linear atau cincin beberapa ahli:
- Anhydride asetik.
- Propanoic anhydride.
- Benzoic anhydride.
- Maleico Anhydride.
- Anhydride succinic.
- Anhydride fthalical.
- Naphthalente -tracarboxylic dianhydride.
- Ethytertarboxylic dianhydride.
- Benzoquinonteterarboxylic dianhydride.
Sama seperti anhydrides dengan oksigen terbentuk, sebatian lain diberikan di mana atom sulfur boleh menggantikan oksigen dalam kumpulan karbonil dan oksigen pusat, seperti: sebagai contoh:
Boleh melayani anda: acetanylide (c8h9no)- Anhydride Tioacetic (Pilih3C (s)2Sama ada)
Terdapat juga kes dua molekul asid yang membentuk pautan dengan atom sulfur yang sama; Sebatian ini dipanggil Tioanhydrides, iaitu:
- Tioanhydride acetic ((CH3Co))2S)
Rujukan
- Wikipedia. (2017). Wikipedia. Diambil dari.Wikipedia.org
- Johnson, a. W. (1999). Jemputan kepada Kimia Organik. Pulih dari buku.Google.co.Pergi.
- Acton, q. Ke. (2011). Hydrolas Anhydride Asid: Kemajuan dalam Penyelidikan dan Aplikasi. Pulih dari buku.Google.co.Pergi
- Bruckner, r., Dan Harmata, m. (2010). Mekanisme Organik: Reaksi, Stereokimia dan Sintesis. Pulih dari buku.Google.co.Pergi
- Kim, j. H., Gibb, h. J., dan Iannucci, ke. (2009). Anhydrides Asid Siklik: Aspek Kesihatan Manusia. Pulih dari buku.Google.co.Pergi

