Atom karbon
- 826
- 228
- Clarence Greenholt DDS
Kami menerangkan apakah atom karbon, struktur elektronik, ciri -ciri, dan hibrida orbital.
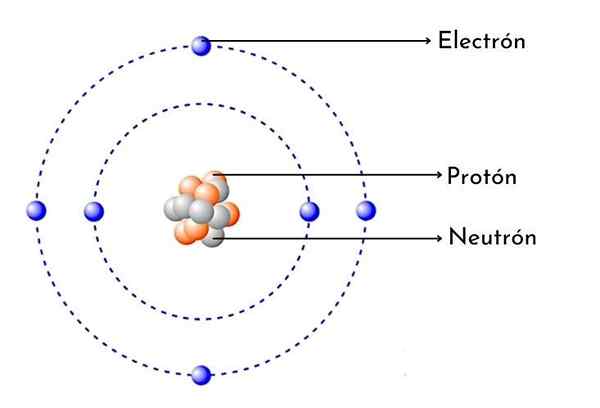
 Skim atom karbon
Skim atom karbon Apa itu Atom Karbon?
Karbon adalah nombor unsur 6 dari jadual berkala dan merupakan salah satu elemen terpenting yang wujud. Kepentingannya timbul dari kimia yang sangat kaya dan bervariasi yang menjadikan elemen ini membentuk Asas kehidupan di planet bumi, Seperti yang kita tahu.
Ini mengenai a bukan logam kepunyaan Kumpulan 14 jadual berkala (dahulunya kumpulan 4A) dan tempoh kedua. Dalam bentuk semula jadi, ia dikaitkan dengan arang batu (kedua -dua mineral dan sayur) dan jelaga, di mana ia terutamanya dalam bentuk grafit atau alotrope lain.
Dia Atom karbon Ia adalah antara yang terkecil dari jadual berkala. Ia adalah atom tetravalen, iaitu, ia boleh membentuk Hingga empat pautan dengan atom lain sama atau berbeza dari yang sama.
Karbon sangat penting bagi manusia. Ini adalah salah satu komponen utama badan kita, membentuk lebih dari 19% jisimnya. Di samping itu, ia juga mempunyai pelbagai aplikasi teknologi yang diperolehi daripada sifat atomnya.
Ciri -ciri atom karbon
- Atom karbon adalah bukan metal: Karbon adalah elemen bukan logam yang boleh digabungkan dengan banyak elemen lain dalam jadual berkala. Atom karbon dapat memperoleh atau memberikan elektron kepada atom lain, menjadi anion atau kation masing -masing.
- Ia mempunyai 6 proton dalam nukleusnya: Bilangan atom karbon adalah 6, yang bermaksud bahawa ia mempunyai 6 proton dalam nukleusnya. Ia juga bermaksud bahawa atom karbon neutral mempunyai 6 elektron di sekitar nukleus.
Boleh melayani anda: pemisahan magnet- Ia tergolong dalam blok P jadual berkala: Konfigurasi karbon elektronik dalam keadaan asasnya ialah 1s2 2s2 2 p2. Seperti yang dapat dilihat, elektron Valencia yang terakhir terletak di orbital P, jadi karbon milik blok p dari jadual berkala.
- Valensi atom karbon adalah +2, +4 dan -4: Lapisan valensi karbon hanya hilang 4 elektron untuk mengisi sepenuhnya dan dengan itu memperoleh konfigurasi elektronik gas neon mulia. Atas sebab ini, karbon boleh membentuk anion karbida, c4-, yang mempunyai 4 elektron lebih daripada karbon neutral. Sebaliknya, atom karbon juga boleh kehilangan dua elektron 2p, sehingga menjadi kation karbon (c2+), atau semua 4 elektron di Valencia, menjadi kation karbonik (c4+).
- Anda boleh membentuk pelbagai alotrop: Karbon asas boleh didapati dalam dua bentuk semula jadi yang biasa ia. Di samping itu, anda boleh membentuk lelaki yang berbeza, karbon dan nanotube graphene.
Tiga isotop atom karbon
Semua atom karbon mempunyai enam proton dalam nukleus mereka, tetapi tidak semua mempunyai bilangan neutron yang sama, yang menimbulkan tiga isotop:
- Karbon-12 (12C): Ia adalah yang paling stabil dan berlimpah (kira -kira 98.9%). Ia mempunyai 6 neutron dalam nukleusnya.
- Karbon-13 (13C): Ia mempunyai 7 neutron.
- Karbon-14 (14C): Ini adalah penggunaan radioaktif untuk tarikh objek lama.
Struktur elektronik atom karbon
Seperti setiap atom karbon, ia mempunyai enam proton positif dalam nukleusnya, maka ia juga mempunyai 6 elektron dengan beban negatif berpaling.
Boleh melayani anda: aliquot (kimia)Cara di mana elektron ini diedarkan atau konfigurasi elektronik atom karbon adalah:
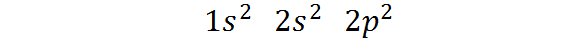
Konfigurasi elektronik ini menunjukkan bahawa Karbon mempunyai 2 elektron dalam orbital 1s, Dua elektron dalam 2s orbital, dan Dua elektron diedarkan di antara tiga orbital 2p.
Sebaliknya, lapisan valensi untuk karbon adalah lapisan L, yang sepadan dengan tahap n = 2, kerana ia adalah lapisan tahap tertinggi yang mengandungi elektron. Seperti yang dapat kita lihat, karbon mempunyai jumlah keseluruhan 4 elektron pada tahap 2, Jadi kita mengatakan bahawa Ia mempunyai 4 elektron Valencia.
Inilah sebab mengapa karbon terletak di mana ia sebelum ini dipanggil kumpulan 4A dari jadual berkala.
Hibridisasi orbital atom dalam atom karbon
Atom bertindak balas dan menghubungkan antara satu sama lain melalui elektron valensi mereka dan orbital yang mereka hadapi. Walau bagaimanapun, yang terakhir tidak selalu mempunyai orientasi yang mencukupi untuk membentuk pautan yang diperlukan.
Teori pautan Valencia menyatakan bahawa atom mencampurkan orbital atom mereka untuk membentuk orbital hibrid baru yang mempunyai bimbingan yang betul. Proses ini dipanggil Hibridisasi.
Bergantung pada bilangan atom yang dihubungkan dengan atom karbon, ia akan mencampur atau menghiburkan bilangan orbital atom tulen yang berbeza. Ini menimbulkan Tiga hibridisasi yang berbeza, Apakah mereka:
Sp
Berlaku apabila karbon hanya dikaitkan dengan Dua atom. Dalam kes ini, Orbital S dengan salah satu daripada tiga orbital P bercampur, menimbulkan dua orbital SP yang menunjuk ke arah yang bertentangan (180º dari satu sama lain).
Boleh melayani anda: barometer merkuriKedua -dua orbital p yang ditinggalkan tanpa pencampuran digunakan untuk membentuk ikatan pi. Atom karbon boleh membentuk Pautan triple (yang mengandungi dua ikatan pi) dengan satu atom, atau boleh membentuk Dua pautan berganda, satu dengan setiap atom (dan dengan pautan pi setiap satu).
Sp2
Apabila Karbon mahu menyertai Tiga atom, Anda memerlukan tiga orbital hibrid, jadi campurkan tiga orbital tulen: orbital s dan dua orbital p. Ini menjana tiga orbital hibrid SP2 yang menunjuk ke sudut segitiga sama rata.
P orbital yang tidak digunakan, boleh membentuk pautan pi dengan mana -mana tiga atom yang dikaitkan, yang menimbulkan ikatan berganda.
Sp3
Apabila karbon akan dihubungkan Empat atom, Campurkan 4 orbital tulen lapisan valensi anda untuk menghasilkan 4 hibrid orbital sp3. Ini menunjuk ke simpang tetrahedron biasa.
Kerana tidak ada orbital untuk membentuk ikatan PI, karbon dengan hibridisasi SP3 Anda hanya boleh membentuk empat pautan mudah dan tidak ada pautan berganda.
Rujukan
- Britannica, editor Encyclopaedia. Karbon - Fakta, Kegunaan, & Harta. Diambil dari https: // www.Britannica.com/sains/karbon-elemen
- Makmal Pemantauan Global. (s. F.). Gas rumah hijau kitaran karbon. Diambil dari https: // gml.Noaa.Kerajaan/CCG/Isotop/Kimia.Html

