Ciri -ciri, struktur, fungsi, faedah Typtophan
- 2549
- 32
- Ms. Edgar Carroll
Dia Tryptophan (TRP, W) adalah asid amino yang diklasifikasikan dalam kumpulan asid amino penting, kerana organisma manusia tidak dapat mensintesisnya dan mesti memperolehnya melalui diet.
Sesetengah makanan seperti susu dan derivatif, daging, telur dan beberapa bijirin seperti quinoa dan soya mengandungi asid amino penting dan, oleh itu, adalah sumber penting tryptophan.
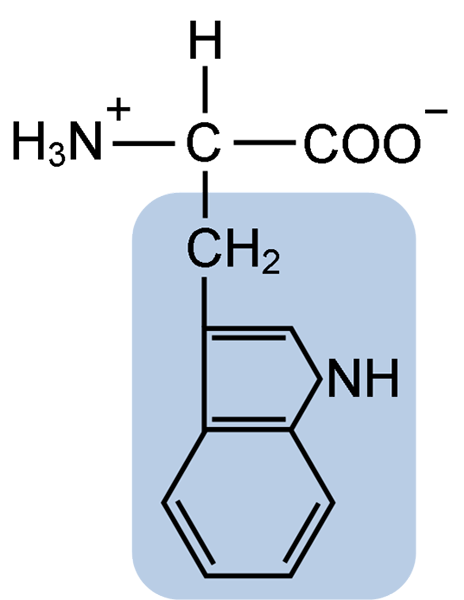
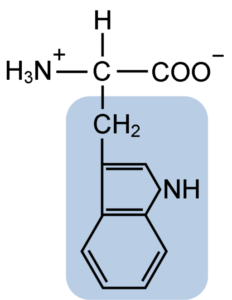 Struktur kimia asid amino Typtophan (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur kimia asid amino Typtophan (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Secara semula jadi, lebih daripada 300 asid amino yang berbeza diketahui dan hanya 22 membentuk unit monomerik protein sel. Antara yang terakhir, 9 adalah asid amino penting, termasuk tryptophan, bagaimanapun, keunggulan masing -masing berbeza antara satu spesies dan yang lain.
Tryptophan mempunyai pelbagai fungsi, di antaranya penyertaan mereka dalam sintesis protein, dalam sintesis serotonin, yang merupakan vasoconstrictor dan neurotransmitter yang kuat, melatonin dan dalam sintesis NAD bersama.
Di dalam kerajaan tumbuhan, tryptophan adalah pendahulu asas hormon tumbuhan yang dikenali sebagai auxin (asid indole-3-asetik). Ia boleh disintesis oleh beberapa bakteria seperti Dan. coli Dari corismato, yang dihasilkan dari beberapa derivatif glikolitik seperti phosphoenolpiruvate dan erythrosa-4-fosfat.
Degradasi dalam mamalia berlaku di hati, di mana ia digunakan untuk sintesis asetil coenzyme A (acetyl-CoA), dan atas sebab ini ia digambarkan sebagai asid amino panggilan glucogenic, kerana ia dapat memasuki kitaran pembentukan glukosa.
Pelbagai kajian telah dilaporkan dengan hasil kontroversi yang berkaitan dengan penggunaan tryptophan sebagai suplemen makanan untuk rawatan beberapa patologi seperti kemurungan dan beberapa gangguan tidur antara lain.
Terdapat beberapa penyakit yang berkaitan dengan kecacatan kongenital dalam metabolisme asid amino. Dalam kes Typtophan, penyakit Hartnup boleh dilantik, disebabkan oleh tryptophan -2,3 -monoxigenase, penyakit keturunan resesif yang dicirikan oleh keterangkuman mental dan perubahan jenis pelagra jenis kulit.
[TOC]
Ciri -ciri
Bersama dengan phenylalanine dan tirosin, tryptophan ditemui dalam kumpulan asid amino aromatik dan hidrofobik.
Walau bagaimanapun, tryptophan dicirikan dengan menjadi asid amino sedikit hidrofobik sejak rantai sampingan aromatiknya, dengan mempunyai kumpulan kutub, melemahkan bahawa hidrofobisitas.
Kerana mempunyai cincin gabungan, mereka mempunyai penyerapan cahaya yang kuat di rantau spektrum dekat dengan ultraviolet dan ciri ini sering digunakan untuk analisis struktur protein.
Ia menyerap cahaya ultraviolet (antara 250 dan 290 nm) dan, walaupun asid amino ini tidak banyak dalam struktur kebanyakan protein tubuh manusia, kehadirannya merupakan sumbangan penting untuk kapasiti penyerapan cahaya di rantau ini 280 nm kebanyakan protein.
Keperluan harian tryptophan berbeza dengan usia. Pada bayi antara 4 dan 6 bulan, keperluan purata adalah kira -kira 17 mg setiap kilogram berat setiap hari; Pada kanak -kanak berumur 10 hingga 12 tahun, ia adalah 3.3 mg setiap kilogram berat sehari dan pada orang dewasa ia adalah 3.5 mg per kilogram berat sehari.
Tryptophan diserap oleh laluan usus dan merupakan asid amino ketogenik dan glikogenik pada masa yang sama.
Oleh kerana ia adalah prekursor serotonin, neurotransmitter penting, tryptophan mesti mencapai sistem saraf pusat (CNS) dan untuk ini ia mesti menyeberangi halangan otak darah, yang mana terdapat mekanisme pengangkutan aktif tertentu.
Boleh melayani anda: Biggy Agar: Yayasan, Penyediaan dan KegunaanStruktur
Tryptophan mempunyai formula molekul C11H12N2O2 dan asid amino penting ini mempunyai rantai sampingan aromatik.
Seperti semua asid amino, tryptophan mempunyai atom karbon α yang dilekatkan pada kumpulan amino (NH2), atom hidrogen (H), kumpulan karboksil (COOH) dan rantai sampingan (r) yang dibentuk oleh struktur heterosiklik, kumpulan indol.
Nama kimianya adalah asid 2-amino-3-propionik, ia mempunyai jisim molekul 204.23 g/mol. Kelarutannya pada 20 ° C ialah 1.06 g dalam 100 g air dan mempunyai ketumpatan 1.34 g/cm3.
Fungsi
Di dalam manusia, tryptophan digunakan untuk sintesis protein dan tidak diperlukan untuk pembentukan serotonin (5-hydroxitriptamine) yang kuat vasoconstrictor, merangsang penguncupan otot licin (terutamanya dalam usus kecil) dan kemurungan neurotransmiter yang dapat dijana oleh stimulasi psikik, dan mengawal kebimbangan.
Tryptophan adalah pendahulu dalam sintesis melatonin dan, oleh itu, mempunyai implikasi dalam kitaran tidur dan vigil.
Asid amino dikatakan sebagai pendahulu dalam salah satu daripada tiga cara untuk pembentukan NAD Cofactor, sebuah cofactor yang sangat penting yang mengambil bahagian dalam pelbagai reaksi enzimatik yang berkaitan dengan peristiwa pengurangan oksida.
Tryptophan dan beberapa prekursornya digunakan untuk pembentukan hormon tumbuh-tumbuhan yang dipanggil auxin (asid indol-3-aktif). Auxin adalah hormon tumbuhan yang mengawal pertumbuhan, pembangunan dan banyak fungsi fisiologi lain.
Biosintesis
Dalam organisma yang mampu mensintesisnya, rangka karbon tryptophan berasal dari phosphoenolpyruvate dan erythrosa-4-fosfat. Ini, seterusnya, dibentuk dari perantara kitaran Krebs: Oxalacetate.
Phosphoenolpiruvate dan erythrous-4-fosfat digunakan untuk sintesis corismate pada tujuh laluan enzimatik. Phosphoenolpiruvate (PEP) adalah produk glikolisis dan erythrous-4-fosfat laluan pentos fosfat.
Bagaimana laluan sintesis Corismate?
Langkah pertama gejala Corismato adalah kesatuan PEP dengan erythrosa-4-fosfat untuk membentuk 2-zo-3-disoxxi-d-anabino-heptulosonato-7-fosfat (DAHP) (DAHP).
Reaksi ini dikatalisis oleh enzim 2-ZO-3-Dexxi-D-Anabino-Heptulosonato-7-phosphate synthase (DAHP Syntasa), yang dihalang oleh korismat.
Tindak balas kedua membayangkan ciclation DAHP oleh synthase dehydrochinate, enzim yang memerlukan co -factor NAD, yang dikurangkan semasa tindak balas ini; Akibatnya, 5-dishydroquinate berlaku.
Langkah ketiga laluan ini membayangkan penghapusan molekul air 5-dehydroquinate, tindak balas yang dikatalisis oleh enzim dehydratase dehydrochinate, yang produk terakhirnya sepadan dengan shikimato 5-dishydro.
Kumpulan keto molekul ini dikurangkan kepada kumpulan hidroksil dan, sebagai akibatnya, shikimato terbentuk. Enzim yang memangkinkan tindak balas ini adalah bergantung kepada NADPH.
Langkah kelima laluan itu membayangkan pembentukan 5-fosfat shikimate dan penggunaan molekul ATP oleh enzim yang dikenali sebagai kinase shikimato, yang bertanggungjawab terhadap fosforilasi shikimate dalam kedudukan 5.
Selepas itu, dari 5-fosfat shikimate dan dengan tindakan 3-enlappiruvil shikimato-5-fosfat synthase, 3-enlappiruvil shikimato 5-fosfat dijana. Enzim yang disebutkan di atas menggalakkan anjakan kumpulan fosforil molekul pep kedua oleh kumpulan hidroksil karbon dalam kedudukan 5 dari 5-fosfat shikimate.
Ia boleh melayani anda: mengapa penting untuk menjaga biodiversiti?Reaksi ketujuh dan terakhir dipangkin oleh corisme synthase, yang menghilangkan fosfat dari 3-enlappate shikimate 5-fosfat dan menjadikannya corismate.
Dalam kulat N. Crassa, Kompleks enzimatik pelbagai fungsi memangkinkan lima daripada tujuh reaksi laluan ini dan kompleks ini ditambah tiga enzim lain yang akhirnya menghasilkan tryptophan.
Sintesis tryptophan dalam bakteria
Dalam Dan. coli, Transformasi Corisme Tryptophan termasuk lima laluan enzimatik tambahan:
Pertama, enzim synthase antranilasi menukarkan corismate menjadi antraniliti. Dalam reaksi ini molekul glutamin mengambil bahagian, disumbangkan oleh kumpulan amino yang mengikat cincin indol tryptophan dan menjadi glutamat.
Langkah kedua dipangkin oleh pemindahan phosphorribosyl antranile. Dalam tindak balas ini molekul pyrophosphate 5-phosphorribosyl-1-pyrophosphate (PRPP) (PRPP) bergerak kaya dengan tenaga, dan N- (5'-phosphorribosyl) terbentuk.
Reaksi ketiga laluan sintesis tryptophan ini membayangkan penyertaan enzim fosforribosil-isomerase. Di sini N- (5'-phorribosyl) -santranylate.
Kemudian fosfat indole-3-gliserol dibentuk, dalam tindak balas yang dikatalisis oleh synthase simpati indol-3-gliserol, di mana CO2 dan molekul H2O dilepaskan dan 1- (o-carboxyphenylamine) -1- desoxyribulosa 5-fosfat.
Reaksi terakhir laluan ini berakhir membentuk tryptophan apabila tryptophan synthase catalyz.
Degradasi
Dalam mamalia, tryptophan terdegradasi di hati ke asetil-CoA pada laluan yang melibatkan dua belas langkah enzimatik: lapan untuk mencapai α-zo-stoadipate dan 4 lagi untuk menukar α-zo-dotadipato menjadi asetil coenzyme untuk.
Perintah degradasi sehingga α-cetoadipato adalah:
Typtophan → N-Quinurenine formil → quinurenin → 3-hydroxi quinurenine → 3-hydroxy-antranilate → ε-semialdehyde 2-amino-3-muconcycix banyak → ε-semialdehido α-amino amouz.
Enzim -enzim yang memangkinkan tindak balas ini adalah:
Typtophan 2-3-dioxigenase, formamidase quinurenine, NADPH yang bergantung kepada monooxigenase NADPH yang bergantung.
Setelah α-cethoadipate dihasilkan, decarboxylation oksidatif terbentuk gluteral-CoA. Ini, oleh pengoksidaan ß, bentuk glutaconyl-CoA yang kehilangan atom karbon bikarbonat (HCO3-), memenangi molekul air dan berakhir sebagai crotonil-CoA.
Crotonil-CoA, juga untuk ß-pengoksidaan, menghasilkan acetyl-CoA. Kata asetil-CoA boleh mengikuti beberapa cara, di antaranya glukoneogenesis, untuk membentuk glukosa dan kitaran Krebs, untuk membentuk ATP, seperti yang diperlukan, seperti yang diperlukan.
Walau bagaimanapun, molekul ini juga boleh diarahkan ke arah pembentukan badan keton, yang akhirnya boleh digunakan sebagai sumber tenaga.
Makanan kaya dengan tryptophan
Daging merah secara umum, ayam dan ikan (terutamanya ikan biru seperti salmon dan tuna) sangat kaya dengan tryptophan. Susu dan derivatifnya, telur, terutama kuning telur, juga makanan dengan banyak kandungan tryptophan.
Makanan lain yang berfungsi sebagai sumber semula jadi asid amino ini ialah:
- Kacang seperti kacang, badam, pistachios dan anacardos, antara lain.
- Bijirin beras.
- Biji -bijian kering seperti kacang, lentil, kacang, kacang soya, quinoa, dll.
- Ragi bir dan kacang segar, pisang dan pisang, nanas atau ananá, alpukat, plum, air, brokoli, bayam dan coklat.
Ia boleh melayani anda: Hiu kapal selam: sejarah, realiti atau fiksyen?Faedah pengambilan anda
Penggunaan Typtophan sangat diperlukan untuk mensintesis semua protein yang termasuk dalam strukturnya dan melalui fungsi yang berbeza ia membolehkan mengawal mood, tidur dan kitaran berjaga -jaga dan pelbagai proses biokimia di mana NAD mengambil bahagian.
Sebagai tambahan kepada kesan yang diketahui terhadap mood, serotonin (tryptophan diperoleh) campur tangan dalam pelbagai fungsi kognitif yang berkaitan dengan pembelajaran dan ingatan yang, oleh itu, juga berkaitan dengan tryptophan.
Terdapat data yang menunjukkan hubungan antara mood, serotonin dan paksi gastrousus-serebrum sebagai sistem pengaruh dua arah antara pusat emosi dan kognitif otak dan fungsi periferal saluran pencernaan.
Digunakan sebagai suplemen makanan untuk rawatan beberapa gangguan, terutama yang berkaitan dengan sistem saraf pusat, sangat kontroversial kerana pengangkutan kompetitifnya dengan asid amino neutral, lebih banyak, menjadikannya sukar untuk mencapai peningkatan yang signifikan dan berterusan dalam tryptophan selepas pentadbiran lisannya.
Walaupun kontroversi ini, penggunaannya telah dianggap sebagai tambahan dalam:
- Rawatan sakit
- Gangguan tidur
- Rawatan kemurungan
- Rawatan mania
- Pengurangan selera makan
Gangguan kekurangan
Penghapusan pusat atau kekurangan tryptophan disertai dengan kemurungan, kegagalan perhatian, penurunan ingatan, gangguan tidur dan kecemasan.
Pada pesakit yang tertekan dan dengan trend bunuh diri, perubahan dalam kepekatan darah dan cecair serebrospinal telah dijumpai. Di samping itu, sesetengah pesakit dengan anoreksia saraf menunjukkan tahap serum rendah tryptophan.
Beberapa pesakit poliurik, yang kehilangan vitamin B6 dan zink, kerap mempunyai fobia dan kecemasan dan bertambah baik dengan makanan tambahan yang kaya dengan triptophane.
Sindrom Carcinoid dicirikan oleh kehadiran tumor usus kecil yang menyebabkan cirit -birit, penyakit vaskular dan bronkokonstrik dan berkaitan dengan defisit niacin dan tripophane
Pelagra adalah keadaan patologi yang disertai oleh cirit -birit, demensia, dermatitis dan boleh menyebabkan kematian, ini juga dirawat dengan suplemen niacin dan tryptophan.
Penyakit Hartnup perlu dilakukan, antara beberapa perkara, dengan kecacatan dalam metabolisme beberapa asid amino, termasuk tryptophan.
Dalam kes dengan defisit enzim typtophan -2,3-monoxigenase, ini adalah penyakit keturunan resesif yang dicirikan oleh keretakan mental dan perubahan kulit jenis kulit.
Rujukan
- Halvorsen, k., & Halvorsen, s. (1963). Penyakit Hartnup. Pediatrik, 31(1), 29-38.
- Hood, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Panik Don. Panduan untuk pengurangan tryptophan dengan provokasi kecemasan khusus gangguan. Jurnal Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. Ke., Nguyen, j. C., Polglaze, k. Dan., & Bertrand, p. P. (2016). Pengaruh tryptophan dan serotonin pada mood dan kognisi dengan peranan yang mungkin paksi usus-boin. Nutrien, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. Ke., Fernstrom, J., Fernstrom, m.,... & Kishore, a. (2003). Kesan anxiolytic dari pengurangan tryptophan akut dalam anoreksia nervosa. Jurnal Antarabangsa Gangguan Makan, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, ms., & Rodwell, v. (2009). Biokimia Illustrated Harper. 28 (ms. 588). New York: McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip Biokimia Lehninger. Macmillan.

