Ciri -ciri proline, struktur, fungsi, makanan
- 1504
- 433
- Ms. Edgar Carroll
The Proline (Pro, p) tergolong dalam 22 asid amino yang diklasifikasikan sebagai asas. Ia adalah asid amino yang tidak penting, kerana ia dapat disintesis oleh manusia dan haiwan mamalia lain.
Pada tahun 1900, saintis Jerman Richard Willstatter adalah yang pertama untuk mengekstrak dan memerhatikan proline. Walau bagaimanapun, ia adalah Emili Fischer, pada tahun 1901, yang mencipta istilah "proline" berdasarkan cincin pyrrolidine asid amino; Penyelidik ini juga berjaya menerangkan secara terperinci sintesis proline dari kasein susu.
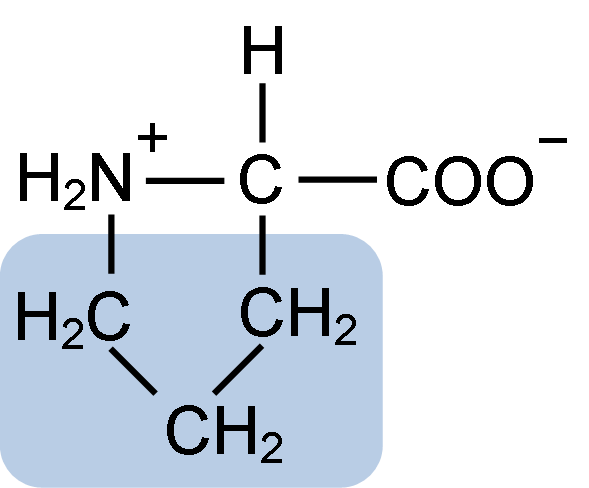
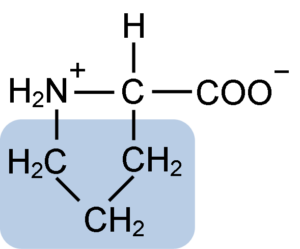 Struktur Kimia Asid Amino Proline (Sumber: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur Kimia Asid Amino Proline (Sumber: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Dalam protein seperti kasein, proline mempunyai fungsi yang sangat diperlukan dalam "giliran" dan lipatan struktur. Dalam protein ini, proline diedarkan secara homogen sepanjang struktur dan pautan ke kasein β dan protein αS1; Di samping itu, ia menghalang gelung struktur yang cacat atau lipat.
Dalam analisis biokimia yang digunakan pada masa ini untuk menentukan urutan sebenar asid amino yang membentuk protein, proline adalah salah satu asid amino pengesanan yang paling sukar, kerana kumpulan amino sekunder proline mempunyai tingkah laku yang berbeza dan tidak dapat dikesan dengan mudah.
Scurvy mungkin penyakit paling terkenal yang berkaitan dengan proline. Ia mempunyai kaitan dengan kekurangan pengambilan vitamin C, yang secara langsung mempengaruhi hidroksilasi prolin dalam gentian kolagen, yang menyebabkan kelemahan sistemik disebabkan oleh ketidakstabilan gentian kolagen yang di seluruh badan.
[TOC]
Ciri -ciri
Kumpulan amino menengah karbon α menjadikan tugas klasifikasi proline agak sukar. Walau bagaimanapun, dalam beberapa teks ini diklasifikasikan di sebelah asid amino bercabang atau dengan rantai sampingan alifatik, kerana rantai sampingan atau r r proline adalah hidrofobik atau alifatik.
Salah satu ciri yang paling penting dalam prolin adalah bahawa tidak ada bentuk jambatan hidrogen, yang menjadikannya ideal untuk menyusun giliran kompleks dan rumit dalam struktur tertiari protein.
Sama seperti semua asid amino mempunyai dua isoforms yang bergantung kepada atom karbon pusat, proline boleh didapati dalam alam seperti l-proline atau sebagai d-prolol. Walau bagaimanapun, bentuk l-prolina adalah sifat yang paling banyak dan merupakan sebahagian daripada struktur protein.
Di dalam protein di mana ia terletak, proline kerap menduduki tempat yang dekat dengan permukaan atau lipatan atau "giliran" rantai polipeptida, kerana struktur kaku dan tertutup proline membuat interaksi yang kuat dengan interaksi asid amino lain sukar.
Struktur
Proline mempunyai struktur tertentu antara asid amino asas, kerana ia membentangkan kumpulan amino (NH2) sekunder dan bukan kumpulan amino utama yang merupakan ciri semua asid amino.
Kumpulan R atau rantaian lateral proline adalah cincin pyrrolidine atau tetrahydropirrol. Kumpulan ini dibentuk oleh amina heterosiklik (tiada ikatan ganda) daripada lima atom karbon, di mana masing -masing adalah tepu dengan atom hidrogen.
Proline mempunyai keanehan bahawa atom karbon "pusat" dimasukkan ke dalam cincin pirolidin heterosiklik, jadi satu -satunya atom "bebas" atau "cemerlang" adalah kumpulan karboksil (COOH) dan atom hidrogen (h) cincin heterosiklik Asid amino.
Boleh melayani anda: dismutase superoxide: ciri, struktur, fungsiFormula molekul proline adalah C5H9NO2 dan nama IUPACnya ialah asid pirrolidin-2-karboksilat. Ia mempunyai berat molekul kira -kira 115.13 g/mol dan kekerapan penampilannya dalam protein adalah kira -kira 7%.
Fungsi
Serat kolagen dan tropocollagen adalah protein yang paling banyak di kebanyakan haiwan vertebrata. Ini membentuk kulit, tendon, matriks tulang, dan banyak tisu lain.
Serat kolagen terdiri daripada banyak pencetus polipeptida tiga kali ganda yang, pada gilirannya, terdiri daripada pelbagai residu proline dan glisin dalam urutan praktik-praktolin/hidroksiprololin (yang terakhir adalah derivatif yang diubahsuai dari proline).
Dalam bentuk asalnya, proline adalah sebahagian daripada procollagen, ini menjadi pendahulu polipeptida kolagen dan beberapa protein lain dari tisu penghubung. Enzim proline hydroxylase.
Apakah fungsi utama prolin dalam gentian kolagen?
Hydroxyproline memberikan ciri -ciri rintangan kolagen, kerana derivatif asid amino ini mempunyai keupayaan untuk membentuk sejumlah besar jambatan hidrogen antara rantai kipas tiga yang membentuk protein.
Enzim -enzim yang memangkinkan hidroksilasi sisa prolin memerlukan kehadiran vitamin C (asid askorbik) dan, seperti yang dinyatakan di atas, skurvi adalah disebabkan oleh kelemahan gentian kolagen akibat kegagalan dalam hidroksilasi sisa proline, yang menyebabkan penurunan Jambatan hidrogen yang mengekalkan serat kolagen.
Fungsi lain
Proline sangat diperlukan untuk pembentukan lipatan dan giliran protein.
Struktur tertutupnya menjadikan asid amino ini sukar untuk "menampung" di dalam protein, sebagai tambahan, kerana ia tidak dapat membentuk jambatan hidrogen untuk "berinteraksi" dengan sisa lain yang berdekatan, ia mendorong pembentukan "giliran" atau "bertukar" di sepanjang struktur protein di mana ia berada.
Semua protein dengan masa hidup yang singkat mempunyai sekurang -kurangnya rantau dengan proline berulang, glutamat, serine dan treonin berulang kali. Kawasan ini dari 12 hingga 60 sisa dan dipanggil urutan perosak.
Protein yang mengandungi urutan perosak ditandai dengan ubiquitination untuk kemerosotan berikutnya dalam proteosom.
Biosintesis
Banyak asid amino boleh disintesis dari perantara glikolisis, pentos fosfat atau kitaran asid sitrik (kitaran Krebs). Proline dan arginine terbentuk di laluan glutamat pendek.
Laluan biosintetik yang hampir sama untuk semua organisma hidup bermula dengan penukaran L-glutamat dalam γ-l-glutamil-5-fosfat berkat tindakan enzim glutamat-5-quinous (dalam bakteria) atau oleh γ-glutamil- Whinas (pada manusia).
Reaksi ini membayangkan fosforilasi yang bergantung kepada ATP, jadi, sebagai tambahan kepada produk utama, molekul ADP dijana.
Tindak balas yang dipangkin oleh dehidrogenase-limid 5-semi glutamate (dalam bakteria) atau oleh γ-glutamil reductase fosfat (pada manusia) menukarkan γ-l-glutamil-5-fosfat ke dalam L-glutamat-5-SEMI-Limid kehadiran Co -factor NADPH.
Boleh melayani anda: separuh stuart: asas, penyediaan dan kegunaanL-glutamato-5-semialdehida boleh diterbalik.
Degradasi
Proline, arginine, glutamin dan histidine sentiasa terdegrad. Dalam kes tertentu proline, ini pertama kali dioksidakan oleh enzim oksidase proline ke pirrolin-5-karboksilat.
Dalam langkah pertama, di mana pengoksidaan proline ke pirrolin-5-karboksilat berlaku, proton terpisah diterima oleh e-FAD, mengurangkan kepada e-FADH2; Langkah ini eksklusif untuk asid amino proline.
Disebabkan reaksi spontan, pirrolin-5-karboksilat diubah menjadi glutamate γ-semialdehid, yang kemudiannya berfungsi sebagai substrat untuk enzim glutamat γ-semi-limidic dehydrogenase. Dalam langkah dua proton ini muncul, salah seorang daripada mereka diterima oleh NAD yang dikurangkan kepada NADH, dan yang lain bebas dalam bentuk H+.
Arginine, seperti proline, diubah menjadi glutamat γ-semialdehid, tetapi melalui laluan metabolik alternatif di mana dua enzim yang berbeza mengambil bahagian.
Γ-semialdehyde glutamate enzim dehidrogenase mengubah glutamat γ-semialdehid ke l-glutamat. Selepas itu, L-glutamat ini dioksidakan lagi oleh enzim glutamat dehidrogenase, yang akhirnya membentuk α-zetoglutarate yang akan dimasukkan ke dalam kitaran asid sitrik.
Dalam laluan pengoksidaan glutamat, proton (H+) dikeluarkan dan kumpulan amino (NH3+). Proton mengurangkan kumpulan NADP+ dan molekul NADPH berasal.
Walaupun terdapat banyak persamaan yang wujud di antara laluan degradasi dan biosintesis prolin dan arginin, asid amino ini disintesis dan direndahkan oleh laluan yang sama sekali bertentangan yang menggunakan enzim yang berbeza, cofactor yang berlainan dan yang berlaku berlainan intraselular yang berbeza.
Makanan yang kaya dengan Valina
Secara umum, semua makanan dengan kandungan protein tinggi mempunyai banyak proline. Antaranya adalah daging, susu, telur dan lain -lain. Walau bagaimanapun, apabila badan kita berada dalam keadaan kesihatan dan pemakanan yang optimum, ia dapat mensintesis proline endogen.
Proline juga boleh didapati dalam banyak kekacang dan kacang dan dalam bijirin seperti oatmeal, contohnya. Makanan proline lain adalah dedak gandum, kacang, badam, kacang, kacang, antara lain.
Beberapa kedai naturist biasanya merumuskan dimampatkan dari asid amino l-lisina dan l-prololina digabungkan untuk membantu orang yang mengalami masalah bersama atau menangguhkan penuaan tisu.
Walau bagaimanapun, ia belum ditunjukkan dengan pasti bahawa makanan tambahan makanan asid amino ini mempunyai kesan yang signifikan terhadap kelewatan usia tua atau keadaan lain dari pendahuluan usia.
Faedah pengambilan anda
Diet yang kaya dengan proline biasanya ditetapkan untuk orang yang mempunyai penyakit bersama seperti arthritis, sprains, pecah ligamen, dislokasi, tendonitis dan lain -lain, dan ini disebabkan oleh hubungan mereka dengan sintesis gentian kolagen yang terdapat dalam tisu penghubung badan.
Boleh melayani anda: agar m.R.S: Apa, asas, penyediaan, kegunaanBanyak losyen dan tablet farmakologi yang digunakan dalam industri estetik diperkaya dengan l-proline, kerana beberapa kajian telah menunjukkan bahawa asid amino ini entah bagaimana meningkatkan sintesis kolagen dan, oleh itu, meningkatkan tekstur kulit, mempercepatkan penyembuhan luka, luka, ulser dan luka bakar.
Dalam industri makanan terdapat protein yang mempunyai "peptida bioaktif" yang berfungsi berfungsi di luar sifat pemakanan mereka. Peptida ini umumnya mempunyai dua hingga sembilan sisa asid amino di antaranya proline, arginine dan lisin berlimpah.
Peptida bioaktif ini mungkin mempunyai aktiviti antihipertensi dengan kesan opioid tertentu; Mereka boleh bertindak sebagai imunomodulator dengan merangsang tindak balas imun terhadap beberapa patogen dan bahkan boleh menyebabkan kenaikan vasoaktiviti, yang meningkatkan peredaran mereka yang memakannya.
Gangguan kekurangan
Gluten adalah protein yang terdapat dalam butiran gandum yang menyebabkan keradangan usus. Orang yang menderita "intoleransi gluten" dikenali sebagai pesakit "celiac" dan diketahui bahawa protein ini kaya dengan proline dan glutamin, yang degradasi proteolitik sukar bagi orang dengan keadaan sedemikian.
Beberapa penyakit ada kaitan dengan lipatan buruk protein penting dan sangat biasa bagi kecacatan ini yang berkaitan dengan isomerisasi Cis-trans pautan amida dalam sisa proline, kerana, tidak seperti pautan peptida lain di mana isomer trans Ia sangat disukai, dalam proline ia kurang bernasib baik.
Dalam sisa proline, telah diperhatikan bahawa terdapat kecenderungan yang ketara ke arah pembentukan isomer Cis pertama daripada isomer trans Di dalam amida bersebelahan dengan sisa proline, yang dapat menjana penyesuaian protein "tidak betul".
Gangguan metabolik
Seperti asid amino penting dan tidak penting yang lain, gangguan patologi utama yang berkaitan dengan prolin yang perlu dilakukan, biasanya, dengan kecacatan pada laluan asimilasi asid amino ini.
Sebagai contoh, hyperprolinemia adalah satu kes yang tipikal kekurangan dalam salah satu enzim yang mengambil bahagian dalam laluan degradasi proline, khususnya dalam dehidrogenase 1-pyroline-5-karboksilat, yang membawa kepada pengumpulan substratnya, yang akhirnya tidak aktif.
Patologi ini biasanya didiagnosis oleh kandungan proline yang tinggi dalam plasma darah dan dengan kehadiran metabolit 1-pyrrololin-5-karboksilat dalam air kencing pesakit terjejas yang terjejas.
Gejala utama penyakit ini terdiri daripada gangguan neurologi, penyakit buah pinggang dan kehilangan kapasiti pendengaran atau pekak. Kes -kes lain yang lebih teruk termasuk kelewatan mental yang teruk dan kesukaran psikomotor yang ditandakan.
Rujukan
- Abu-Baker, s. (2015). Ulasan Biokimia: Konsep dan Sambungan
- Delauney, a. J., & Verma, D. P. S. (1993). Biosintesis dan osmoregulation proline dalam tumbuh -tumbuhan. Jurnal Loji, 4 (2), 215-223.
- Senarai, b., Lerner, r. Ke., & Barbas, c. F. (2000). Proline-catalyzed reaksi aldol asimetrik langsung. Jurnal Persatuan Kimia Amerika, 122 (10), 2395-2396
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip Biokimia Lehninger. Macmillan.
- Plimmer, r. H. Ke. (1912). Perlembagaan Kimia Protein (Vol. 1). Longmans, Hijau.
- Szabados, l., & Savouré, ke. (2010). Proline: Asid amino pelbagai fungsi. Trend dalam Sains Tumbuhan, 15 (2), 89-97.

