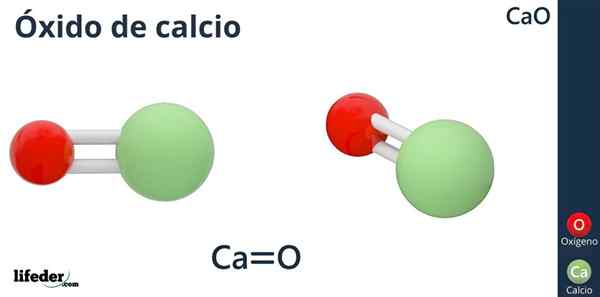
Kalsium oksida (CAO)
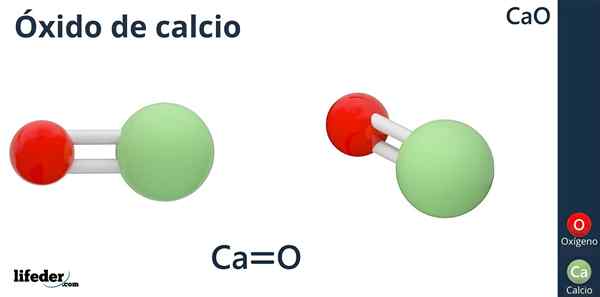
- 1359
- 406
- Anthony Breitenberg
Apa itu kalsium oksida?
Dia Kalsium oksida (CaO) adalah sebatian bukan organik yang mengandungi kalsium dan oksigen dalam bentuk ionik (tidak mengelirukan dengan kalsium peroksida, CaO2). Dikenali sebagai Lime, perkataan yang menunjuk setiap sebatian bukan organik yang mengandungi karbonat, oksida dan kalsium hidroksida, sebagai tambahan kepada logam lain seperti silikon, aluminium dan besi.
Ke oksida ini (atau kapur) juga merujuk secara koloki sebagai hidup atau kapur, bergantung kepada sama ada ia terhidrasi atau tidak. Lime Lime adalah kalsium oksida, sementara kapur adalah hidroksida. Sebaliknya, batu kapur (kapur atau kapur keras) sebenarnya batu sedimen yang terdiri terutamanya daripada kalsium karbonat (CACO3).
Ia adalah salah satu sumber kalsium semula jadi terbesar dan merupakan bahan mentah untuk pengeluaran kalsium oksida. Bagaimana oksida ini dihasilkan? Karbonat mudah terdedah kepada penguraian haba; Pemanasan kalsium karbonat pada suhu lebih besar daripada 825 ºC, membawa kepada pembentukan kapur dan karbon dioksida.
Kenyataan sebelumnya dapat digambarkan seperti berikut: Caco3(s) → cao (s) + co2(g). Kerana kerak bumi kaya dengan batu kapur dan kalsit, dan di lautan dan pantai kerang laut (bahan mentah untuk pengeluaran kalsium oksida) berlimpah, kalsium oksida reagen yang agak murah.
Formula
Formula kimia kalsium oksida adalah CaO, di mana kalsium adalah seperti ion asid (penerima elektron) ca2+, dan oksigen seperti ion asas (penderma elektron) atau2--.
Mengapa kalsium mempunyai caj +2? Kerana kalsium tergolong dalam kumpulan 2 jadual berkala (SR. Scholambara), dan hanya mempunyai dua elektron valensi yang tersedia untuk pembentukan pautan, yang menghasilkan atom oksigen.
Boleh melayani anda: Potassium Oxide (K2O)Struktur kalsium oksida
 Struktur kristal kalsium oksida
Struktur kristal kalsium oksida Struktur kristal (jenis garam permata) untuk kalsium oksida diwakili dalam imej atas. Sfera merah besar sesuai dengan ion ca2+ dan sfera putih ke ion atau2-.
Dalam susunan kristal padu ini setiap ion ca2+ dikelilingi oleh enam ion atau2-, Occloured di lubang octahedral yang ditinggalkan oleh ion besar di antara mereka.
Struktur ini menyatakan maksimum sifat ionik oksida ini, walaupun perbezaan radio yang luar biasa (sfera merah lebih besar daripada putih) memberikan tenaga reticular kristal yang lebih lemah jika dibandingkan dengan MGO.
Sifat kalsium oksida
 Penampilan kalsium oksida
Penampilan kalsium oksida Secara fizikal, ia adalah pepejal putih kristal, tandas dan dengan interaksi elektrostatik yang kuat, yang bertanggungjawab untuk titik penggabungan yang tinggi (2572 ºC) dan mendidih (2850 ºC). Di samping itu, ia mempunyai berat molekul 55,958 g/mol dan harta yang menarik sebagai thermoluminescent.
Ini bermaksud bahawa sekeping kalsium oksida yang terdedah kepada api dapat bersinar dengan cahaya putih yang sengit, yang dikenali dalam bahasa Inggeris dengan namanya Limelight, atau dalam bahasa Sepanyol, cahaya kalsium. Ion ca2+, Hubungan dengan api, mereka berasal api kemerahan, seperti yang dapat dilihat dalam gambar berikut.
 Cahaya kalsium atau perhatian
Cahaya kalsium atau perhatian Kelarutan
CAO adalah oksida asas yang mempunyai pertalian yang kuat untuk air, hingga tahap yang menyerap kelembapan (ia adalah pepejal hygroscopic), bertindak balas dengan segera untuk menghasilkan dimatikan atau kalsium hidroksida:
Cao (s) + h2Atau (l) => ca (oh)2(S)
Tindak balas ini adalah eksotermik (ia menyerahkan haba) kerana pembentukan pepejal dengan interaksi yang lebih kuat dan rangkaian kristal yang lebih stabil. Walau bagaimanapun, tindak balas boleh diterbalikkan jika CA (OH) dipanaskan2, menghidangkan dan menyalakan kapur; Kemudian, kapur "dilahirkan semula".
Boleh melayani anda: Safranine: Ciri, Penggunaan, Teknik, KetoksikanPenyelesaian yang dihasilkan sangat asas, dan jika tepu dengan kalsium oksida ia mencapai pH 12.8.
Begitu juga, larut dalam gliserol dan penyelesaian asid dan manis. Seperti oksida asas, secara semulajadi mempunyai interaksi yang berkesan dengan oksida asid (SIO2, Kepada2Sama ada3 dan iman2Sama ada3, Sebagai contoh) larut dalam fasa cecair mereka. Sebaliknya, ia tidak larut dalam alkohol dan pelarut organik.
Penggunaan/aplikasi
CAO mempunyai penggunaan perindustrian yang banyak, serta dalam sintesis asetilena (CH Afrika), dalam pengekstrakan fosfat air sisa dan reaksi dengan sulfur dioksida minuman ringan.
Kegunaan lain kalsium oksida diterangkan di bawah:
Sebagai mortar
Sekiranya kalsium oksida dicampur dengan pasir (SIO2) dan air, kek dengan pasir dan bertindak perlahan dengan air untuk membentuk kapur yang membosankan. Sebaliknya, CO2 Dari udara larut di dalam air dan bertindak balas dengan garam untuk membentuk kalsium karbonat:
CA (oh)2(s) + co2(g) => Caco3(s) + h2Atau (l)
Caco3 Ia adalah sebatian yang lebih tahan dan keras daripada CaO, menyebabkan mortar (campuran sebelumnya) untuk mengeras dan memperbaiki batu bata, blok atau seramik di antara mereka atau ke permukaan yang dikehendaki.
Dalam pengeluaran kaca
Bahan mentah penting untuk pengeluaran kaca adalah oksida silikon, yang dicampur dengan kapur, natrium karbonat (NA2Co3) dan bahan tambahan lain, dan kemudian tertakluk kepada pemanasan, mengakibatkan pepejal kaca. Pepejal ini kemudiannya dipanaskan dan ditiup dalam mana -mana angka.
Dalam perlombongan
Lime yang membosankan menduduki jumlah yang lebih besar daripada kapur hidup kerana interaksi oleh jambatan hidrogen (O-H-O). Harta ini dieksploitasi untuk memecahkan batu dari anggarannya.
Boleh melayani anda: hidrogenasi pemangkinIni dicapai dengan mengisi mereka dengan campuran kapur dan air yang padat, yang dimeteraikan untuk memfokuskan haba dan kuasa luasnya di dalam batu.
Sebagai ejen penghilang silikat
Cao bergabung dengan silikat untuk membentuk cecair bersatu, yang kemudiannya diekstrak dari bahan mentah dari produk tertentu.
Sebagai contoh, mineral besi adalah bahan mentah untuk pengeluaran besi dan keluli logam. Galian ini mengandungi silikat, yang tidak diingini untuk proses dan dihapuskan oleh kaedah yang baru diterangkan.
Nanopartikel kalsium oksida
Kalsium oksida boleh disintesis sebagai nanopartikel, pelbagai kepekatan kalsium nitrat (CA (NO3)2) dan natrium hidroksida (NaOH) dalam larutan.
Zarah -zarah ini adalah sfera, asas (serta pepejal hingga skala makro) dan mempunyai banyak kawasan permukaan. Oleh itu, sifat -sifat ini memberi manfaat kepada proses pemangkin. Yang? Siasatan sedang menjawab soalan itu.
Nanopartikel ini telah digunakan untuk mensintesis sebatian organik yang digantikan - seperti yang diperolehi dari piridin - dalam perumusan ubat -ubatan baru untuk menjalankan transformasi kimia seperti fotosintesis buatan, untuk pembersihan air dari logam berat dan berbahaya, dan sebagai agen fotokatalik.
Nanopartikel boleh disintesis atas sokongan biologi, seperti pepaya dan daun teh hijau, untuk memberi mereka penggunaan sebagai agen antibakteria.
Rujukan
- Scifun.org. (2018). Lime: Kalsium oksida. Pulih dari: scifun.org.
- Wikipedia. (2018). Kalsium oksida. Diperoleh dari: dalam.Wikipedia.org
- Pubchem. (2018). Kalsium oksida. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Shiver & Atkins. (2008). Kimia bukan organik. Dalam Unsur -unsur kumpulan 2. (Edisi Keempat., p. 280). MC Graw Hill.