Sifat klorin oksida (v), struktur, kegunaan

- 2100
- 519
- Ms. Santos Fritsch
Dia Klorin oksida (V) Ia adalah sebatian bukan organik yang sangat tidak stabil yang formula kimianya adalah Cl2Sama ada5. Ia adalah salah satu daripada banyak oksida klorin, yang dicirikan oleh spesies molekul, atau bahkan radikal.
Cl2Sama ada5 Dia hanya menemui kehidupan di atas kertas dan pengiraan teoritis; Walau bagaimanapun, kewujudannya belum diketepikan dan kemungkinan ada yang dapat dicirikan (oleh teknik spektroskopi canggih)). Apa yang disebabkan oleh konsep kimia umum boleh diramalkan oksida ini, adalah bahawa ia adalah anhidrida asid klorik, HCLO3.
 Molekul CL2O5. Sumber: Jynto [CC0].
Molekul CL2O5. Sumber: Jynto [CC0]. Molekul klorin oksida hipotetikal (V) ditunjukkan di atas (v). Perhatikan bahawa kerana ia adalah molekul, kehadiran Cl+5; Lebih kurang apabila dia mesti mempunyai kuasa polarisasi untuk memaksa oksigen, menghubungkan kovalen.
Seperti mana -mana sebatian yang tidak stabil, ia mengeluarkan tenaga untuk mengurai dalam produk yang lebih stabil; proses yang dalam banyak kes adalah letupan. Apabila Cl2Sama ada5 Ia memecah kebebasan2 I2. Ia berteori bahawa di dalam air, bergantung kepada isomer Cl2Sama ada5, Beberapa oxoacid klorin boleh dibentuk.
[TOC]
Sifat
Jisim molar cl2Sama ada5 adalah 150,9030 g/mol. Dari jisim ini, dan molekul hipotesisnya, ia boleh diramalkan bahawa jika ia boleh diasingkan, ia mungkin akan menjadi cecair berminyak; Sudah tentu, membandingkannya dengan penampilan fizikal Cl2Sama ada7.
Walaupun ia tidak dapat diasingkan atau dicirikan, oksida klorin ini berasid, kovalen dan juga mesti mempunyai momen dipol kecil. Keasidannya dapat difahami jika persamaan kimia hidrolisisnya dianalisis:
Boleh melayani anda: Undang -undang Amagat: Penjelasan, Contoh, LatihanCl2Sama ada5 + H2Atau 2hclo3
Menjadi HCLO3 Asid klorik. Reaksi terbalik akan mengakibatkan kes bahawa asid boleh dehidrasi:
2hclo3 => Cl2Sama ada5 + H2Sama ada
Sebaliknya, ketika Cl2Sama ada5 Sebaik sahaja ia berlaku, ia terurai:
2Cl2Sama ada5 => 4clo2 + Sama ada2
Oleh itu, ia adalah spesies perantara dan bukannya oksida dengan betul. Penguraiannya mesti begitu pantas (memandangkan CL terbentuk2Sama ada5), yang tidak dapat dikesan oleh teknik analisis instrumental semasa.
Struktur oksida klorin (V)
Molekul
Di bahagian atas, struktur molekul CL hipotesis ditunjukkan2Sama ada5 Dengan model sfera dan bar. Sfera merah mewakili atom oksigen, dan hijau ke klorin. Setiap klorin mempunyai persekitaran piramid trigonal, jadi hibridinya mestilah SP3.
Oleh itu, molekul CL2Sama ada5 Ia dapat dilihat sebagai dua piramid trigonal yang dikaitkan dengan oksigen. Tetapi jika diperhatikan dengan teliti, piramid membimbing atom oksigennya, dan yang lain keluar dari satah (ke arah pembaca).
Dari sini dianggap terdapat putaran dalam pautan atau2CL-O-CL2, menjadikan molekul agak dinamik. Perhatikan bahawa formula atau2Cloclo2 Ini adalah cara untuk mewakili struktur Cl2Sama ada5.
Struktur Lewis
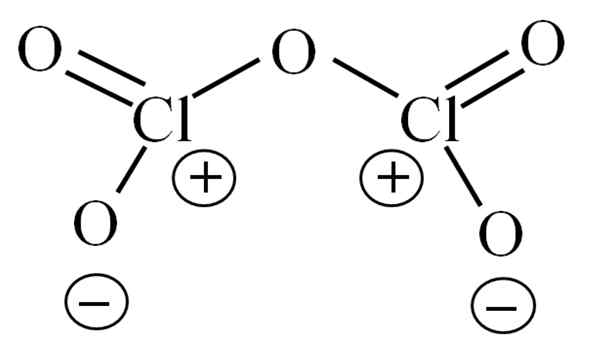 Struktur Lewis untuk CL2O5 hipotesis. Sumber: Gabriel Bolívar.
Struktur Lewis untuk CL2O5 hipotesis. Sumber: Gabriel Bolívar. Sehingga kini molekul itu sendiri tidak membenarkan menafsirkan ketidakstabilannya. Untuk memberi penjelasan kepada soalan ini, struktur Lewis digunakan, diwakili di atas. Perhatikan bahawa ia salah difikirkan bahawa strukturnya rata, tetapi di sub -bahagian anterior ia dijelaskan bahawa ia tidak begitu.
Boleh melayani anda: Natrium Azid (NAN3): Struktur, Hartanah, Kegunaan, RisikoMengapa kedua -dua atom klorin mempunyai beban formal positif? Kerana klorin mempunyai sepasang bebas daripada elektron, yang boleh disahkan apabila teori pautan Valencia digunakan (yang disebabkan oleh penyederhanaan tidak akan dilakukan di sini). Oleh itu, beban formalnya ialah:
CF = 7 - (4 + 2) = 1
Dan apa kaitannya dengan ketidakstabilan anda? Nah, klorin adalah jauh elektronegatif, dan oleh itu pembawa buruk beban formal positif. Ini kembali ke CL2Sama ada5 Spesies yang sangat berasid, kerana ia perlu mendapatkan elektron untuk membekalkan permintaan elektronik kedua -dua kloros.
Sebaliknya berlaku dengan BR2Sama ada5 dan i2Sama ada5, oksida yang wujud dalam keadaan normal. Ini kerana kedua -dua bromin dan iodin kurang elektronegatif daripada klorin; Dan oleh itu, mereka menyokong beban formal positif yang lebih baik.
Isomer dan hidrolisis masing -masing
Setakat ini keseluruhan penjelasan telah jatuh ke salah satu daripada dua isomer CL2Sama ada5: O2Cloclo2. Yang lain? O3Cloclo. Dalam isomer ini, kloros tidak mempunyai beban formal yang positif, dan oleh itu harus menjadi molekul yang lebih stabil. Walau bagaimanapun, kedua -dua atau2Cloclo2 seperti o3Cloclo harus mengalami reaksi hidrolisis:
Sama ada2CL-O-CL2 + H2O => ke -22Cl-oh (yang tidak lebih daripada HCLO3)
Sama ada3Cl-o-clo + H2O => o3Cl-oh (hclo4) + Ho-clo (hclo2)
Perhatikan bahawa sehingga tiga oxoacid klorin boleh dibentuk: HCLO3, Hclo4 Dan hclo2
Nomenclature
Namanya 'klorin oksida (v)' sepadan dengan yang ditugaskan mengikut tatanama saham. Cl2Sama ada5 Ia juga boleh mempunyai dua nama lain: dicloro dan cloring anhydride pentaoxide, yang ditugaskan oleh nomenclatures sistematik dan tradisional, masing -masing.
Boleh melayani anda: Titanium: Sejarah, Struktur, Hartanah, Reaksi, KegunaanAplikasi
Lebih daripada memotivasi kajian komputer, CL2Sama ada5 Ia akan kekurangan penggunaan sehingga ia ditemui, terpencil, dicirikan, disimpan dan telah menunjukkan bahawa ia tidak meletupkan hubungan yang sedikit.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Sandra Luján Quiroga dan Luis José Perissinotti. (2011). Oxoacid klorin dan struktur oksida dichlorine. Chem. Pendidik, Vol. 16.
- Perumusan kimia. (2019). Klorin oksida (V). Pulih dari: formulasi quimica.com
- Linus Pauling. (1988). Kimia Am. Penerbitan Dover, Inc., New York.
- Richard c. Ropp. (2013). Ensiklopedia sebatian Bumi Alkali. Elsevier.

