Struktur hidroksida (ii) besi, sifat, kegunaan
- 945
- 107
- Donnie Ryan
Dia hidroksida besi (II), Juga dipanggil ferrous hidroksida, ia adalah sebatian formula kimia iman yang tidak organik (OH)2. Sekiranya kesuciannya tinggi, pepejalnya hanya terdiri daripada ion iman2+ Dan oh- Dalam hubungan 2: 1; Walau bagaimanapun, molekul air dan spesies ionik yang berbeza mungkin mengandungi, mengubah kedudukannya.
Mewakili bentuk "dikurangkan" dari karat yang terkenal, permukaan kemerahan yang terdiri daripada ion iman3+; Semasa dalam karat kehijauan, iman mendominasi2+, di sebelah oh- dan jumlah anion yang lain: co32-, SW42-, Tidak3- dan haluros (f-, Cl-,… ), Sebagai contoh. Hasilnya, walaupun pangkalan karat hijau ini adalah iman (OH)2, adakah pelbagai pepejal diperolehi.
 Oksida hijau pada permukaan besi: Bahan sumber jenis hidroksida ini. Sumber: Pixabay.
Oksida hijau pada permukaan besi: Bahan sumber jenis hidroksida ini. Sumber: Pixabay. Dalam kehidupan seharian ini hidroksida dapat dipertimbangkan di tempat yang sama. Sebagai contoh, kapal imej atas mempunyai permukaan karat hijau yang dilindungi (bukan patina). Ada iman (oh)2, tetapi disertai dengan banyak ion dari gelombang laut.
Secara kimia, sifat dan penggunaan bahan ini bergantung pada kation iman2+ dan kecenderungannya untuk mengoksida untuk berubah menjadi iman3+. Ia adalah ejen pengurangan, yang bertindak balas dengan cepat dengan oksigen di bawah keadaan asas. Oleh itu ia harus digunakan dalam penyelesaian atmosfera dan asid lengai.
[TOC]
Struktur hidroksida besi (ii)
Pautan
Memandangkan Hanya Iman (OH)2 Murni, tidak ada lagi kepercayaan iman2+ Dan oh-.
Interaksi di antara mereka mestilah, secara teori, sifat ionik; Setiap iman iman2+ menarik dua anion oh-, yang tarikan -tarikan bukan arah akhirnya mewujudkan susunan struktur dan berulang yang menentukan kristal; yang seterusnya, menimbulkan habuk karat hijau.
Ia boleh melayani anda: zink hidroksida (Zn (OH) 2)Masalahnya ialah terdapat watak kovalen tertentu antara kedua-dua ion, dan oleh itu, pautan Fe-OH ionik tidak dapat diabaikan. Memandangkan pautan Fe-OH sebahagian ionik, dapat difahami bahawa mereka dikelompokkan ke dalam jenis lapisan polimer.
Lapisan dua hidroksida
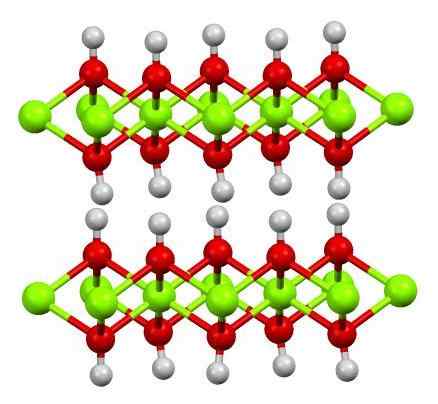
 Struktur Iman (OH) 2. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Struktur Iman (OH) 2. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Struktur hidroksida ferus tulen dengan model sfera dan bar ditunjukkan di atas. Fe kation2+ Mereka diwakili oleh sfera hijau chillón, sementara oh anion- Untuk sfera merah dan putih. Perhatikan bagaimana ion iman diselaraskan2+ Terima kasih kepada interaksi (ionik-kovalen) dengan oh-.
Mengapa struktur ini lapisan dua hidroksida? Imej itu sendiri menawarkan jawapannya: terdapat dua baris atau lapisan oh- Untuk setiap iman2+; iaitu, perkadaran 2: 1 iman (OH) dikekalkan2 disebut pada awal.
Unit Struktur untuk Iman (OH)2 Mereka kemudiannya sandwic ini, di mana lapisan oh- Mereka akan datang untuk mewakili roti; Oleh itu, roti yang dimuatkan secara negatif dan oleh itu, gagal membetulkan kristal coklat yang mencolok.
Tetapi, sebaliknya, atom H juga menyelaraskan dan gerhana antara satu sama lain. Mengingat konsep polariti dan elektronegativiti, hidrogen ini mempunyai beban separa positif yang sedikit, δ+; yang, walaupun lemah, boleh mempunyai kawasan positif di mana anion atau molekul lain ditempatkan.
Menghidrat
Ketika iman (oh)2 Ia larut di dalam air, molekulnya menyelaras dengan pusat iman logam2+ Untuk membentuk ACU yang kompleks: [Iman (H2Sama ada)4(Oh)2]. Kompleks ini mempunyai geometri octahedral kerana mempunyai enam ligan: empat molekul air dan dua oh-. Walau bagaimanapun, dalam hidroksida ferus panorama agak berbeza.
Boleh melayani anda: undang -undang mengenai pemuliharaan bahanDalam hidrat, formula hipotetikal Fe (OH)2· NH2Atau, molekul air ditempatkan tepat di antara kedua -dua lapisan hidroksida; iaitu, mereka berinteraksi melalui daya dipole-ion dengan hidrogen putih atau sfera. Seolah -olah dua perlawanan ohfeoh ditangkap dan air diselingi untuk kumpulan mereka: ohfeoh (h2O) Ohfeah.
Molekul air sangat dinamik, mencegah zarah hidrat daripada memperoleh saiz yang besar dan, dengan itu, membentuk koloid atau jeli pepejal.
Karat hijau dan merah
Dalam menghidrat lapisan hidroksida mempunyai molekul air yang diselingi; Walau bagaimanapun, mereka boleh mempunyai anion lain (sudah disebutkan), menyebabkan pelbagai jenis Herrbles hijau. Mereka juga boleh "menangkap" molekul sebanyak DNA, atau ubat.
Bukan sahaja ion iman boleh hadir2+, tetapi juga iman3+, produk pengoksidaan dalaman yang disebabkan oleh oksigen yang diselingi. Dengan jelasnya diperhatikan bahawa karat hijau (u oksida) mula menjadi kemerah -merahan kerana kepekatan iman meningkat3+.
Sifat
 Tiub ujian dengan hidroksida ferus di dalam air. Sumber: ChemicalInterest [Domain Awam]
Tiub ujian dengan hidroksida ferus di dalam air. Sumber: ChemicalInterest [Domain Awam] Iman (OH) ditunjukkan di atas2 mendakan dalam tiub ujian. Berada di dalam air yang berlimpah, Acu kompleks mesti mendominasi di atas struktur yang baru disebutkan. Perhatikan bahawa permukaannya kelihatan seperti warna oren, hasil daripada pengoksidaan iman2+ untuk iman3+ untuk oksigen udara; Iaitu, hidroksida ini adalah ejen pengurangan:
Iman2+ Iman3+ + dan-
Penampilan fizikal kompaun ini dalam keadaan paling murni adalah pepejal coklat:
 Hidroksida ferus tulen. Sumber: Ondřej Mangl [Domain Awam]
Hidroksida ferus tulen. Sumber: Ondřej Mangl [Domain Awam] Yang, bergantung pada tahap kelembapannya, boleh dibentangkan sebagai pepejal jeli -hijau. Ia agak tidak larut dalam air (ksp= 8 · 10-16 dan kelarutan = 0.72 g/100ml pada 25ºC), dan mempunyai jisim molar 89.86 g/mol dan ketumpatan 3.4 g/ml.
Ia dapat melayani anda: 20 jenis kimia dan penolakan merekaTiada titik mendidih atau gabungan untuk sebatian ini dilaporkan; Mungkin disebabkan oleh hakikat bahawa, sebelum sumber haba, ia menjadi dehidrasi dan ditukar menjadi ferus oksida, hodoh:
Iman (oh)2 => Jelek + h2Sama ada
Aplikasi
Analisis kualitatif organik
Kuasa pengurangannya digunakan untuk menentukan kehadiran sebatian nitro, RNO2. Reaksi yang mana ujian positif diperolehi diwakili dengan persamaan kimia berikut:
Rno2 + 6fe (oh)2 + 4H2O => rnh2 + 6fe (oh)3
Iman (oh)3 Precipitates sebagai pepejal coklat -redizo, yang mengesahkan kehadiran kumpulan nitro, -no2.
Selenium oxoanions reducer
Kekuatan iman yang mengurangkan (OH)2 Ia juga digunakan untuk mengurangkan anion SEO32- (Selenito) dan SEO42- (selenate) ke selenium asas,. Secara praktiknya, ia membolehkan penyingkiran anion sedemikian, berbahaya kepada kesihatan, dalam bentuk pepejal selenium yang tidak larut dan mudah ditanggalkan.
Bahan Lapisan Double
Struktur murni, dan karat hijau, adalah sumber inspirasi untuk reka bentuk bahan -bahan baru ciri -ciri mineralogi.
Dianggarkan bahawa fungsi ini membolehkan pengangkutan spesies tertentu di antara lapisannya, sedemikian rupa sehingga pembebasannya dapat dikawal atau dikurangkan ke tapak aktif (tanah, sel, permukaan logam, dan lain -lain.).
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Besi (ii) hidroksida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Ferrous hidroksida. Pangkalan data PUBCHEM. CID = 10129897. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Nick Doe. (s.F.). Ujian untuk fenol dan kumpulan nitro. Kimia 211. Diperolehi daripada: ahli akademik.Wellesley.Edu
- Clark Jim. (27 April 2019). Kimia Besi. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Perisian Teknikal Kingston. (2019). Kimia Karat. Doktor kakisan. Pulih dari: corrosion-dotors.org
- Zingaro, Ralph a. et al. (1997). Pengurangan anion oxoselenium oleh besi (ii) hidroksida. Alam Sekitar Antarabangsa. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9

