Struktur Strontium Oxide (SRO), Hartanah, Aplikasi

- 2165
- 540
- Anthony Breitenberg
Kami menerangkan apa strontium oksida, struktur kimia, sifat fizikal dan kimia, aplikasi dan risiko adalah
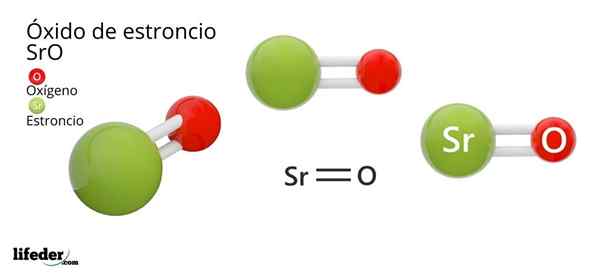
Dia Strontium oksida, Formula kimia yang sro (tidak boleh dikelirukan dengan strontium peroksida, iaitu SRO2), adalah hasil tindak balas oksidatif antara logam ini dan oksigen yang terdapat di udara pada suhu bilik: 2SR (s) + O2 (g) → 2Sro (s).
Sekeping strontium terbakar bersentuhan dengan udara akibat kereaktifan yang tinggi, dan kerana ia mempunyai konfigurasi elektronik jenis NS2, dua elektron valensi mudah menghasilkan, terutama molekul oksigen diatomik.
Sekiranya kawasan permukaan logam ditambah dengan menyemburnya sehingga ia mempunyai serbuk yang dibahagikan dengan baik, tindak balas berlaku dengan segera, dan juga terbakar dengan api kemerahan yang sengit. Strontium, logam yang mengambil bahagian dalam tindak balas ini, adalah logam kumpulan 2 dari jadual berkala.
Kumpulan ini terdiri daripada unsur -unsur yang dikenali sebagai alkali. Yang pertama dari unsur -unsur yang diketuai oleh kumpulan itu adalah berilium, diikuti oleh magnesium, kalsium, strontium, barium, dan akhirnya, radio. Unsur -unsur ini bersifat logam dan, sebagai peraturan mnemonik untuk mengingati mereka, ungkapan boleh digunakan: "SR. Becambara ".
"MR" yang mana ungkapan itu merujuk tidak lain adalah strontium logam (SR), elemen kimia yang sangat reaktif yang tidak secara semula jadi dijumpai dalam bentuk murni, tetapi digabungkan dengan unsur -unsur alam sekitar atau persekitarannya untuk menimbulkan Garam, nitrida dan oksida.
Atas sebab ini, mineral dan strontium oksida adalah sebatian di mana strontium ditemui dalam alam semula jadi.
[TOC]
Ciri -ciri fizikal dan kimia strontium oksida
 Penampilan fizikal strontium oksida
Penampilan fizikal strontium oksida Strontium Oxide adalah sebatian putih, berliang dan tandas yang padat dan, bergantung kepada rawatan fizikalnya, boleh didapati di pasaran sebagai debu halus, seperti kristal atau sebagai nanopartikel.
Boleh melayani anda: oksidaBerat molekulnya ialah 103,619 g/mol dan mempunyai indeks biasan tinggi. Ia mempunyai titik gabungan (2531 ºC) dan mendidih (3200 ° C), yang diterjemahkan ke dalam interaksi pautan yang kuat antara strontium dan oksigen. Titik lebur yang tinggi ini menjadikannya bahan terma yang stabil.
BASIC OXIDE
Ia adalah oksida yang sangat asas; Ini bermakna ia bertindak balas pada suhu bilik dengan air untuk membentuk strontium hidroksida (SR (OH) 2):
Sro (s) + h2o (l) → sr (OH) 2
Kelarutan
Ia juga bertindak balas atau mengekalkan kelembapan, ciri penting sebatian hygroscopic. Oleh itu, strontium oksida mempunyai kereaktifan yang tinggi dengan air.
Dalam pelarut lain - contohnya, alkohol seperti etanol farmasi atau metanol - sedikit larut; Semasa dalam pelarut seperti aseton, eter atau diklorometana, ia tidak larut.
Mengapa seperti ini? Kerana oksida logam -dan lebih banyak lagi yang terbentuk dari logam alkalinother -adalah sebatian kutub dan oleh itu berinteraksi dengan tahap yang lebih baik dengan pelarut kutub.
Bukan sahaja boleh bertindak balas dengan air, tetapi juga dengan karbon dioksida, menghasilkan strontium karbonat:
Sro (s) + CO2 (g) → srco3 (s)
Ia bertindak balas dengan asid - sebagai contoh, asid fosforik yang dicairkan - untuk menghasilkan garam garam dan garam fosfat:
3SRO (S) + 2 H3PO4 (DIL) → Sr3 (PO4) 2 (s) + 3H2O (G)
Reaksi ini adalah eksotermik, oleh itu air yang dihasilkan disejat oleh suhu tinggi.
Struktur kimia
Struktur kimia sebatian menerangkan bagaimana atomnya di angkasa. Dalam kes strontium oksida, ia membentangkan struktur kristal jenis garam permata, garam meja yang sama atau natrium klorida (NaCl).
Boleh melayani anda: kalsium bikarbonatTidak seperti NaCl, garam monovalen -iaitu, dengan kation dan anion magnitud beban (+1 untuk Na dan -1 untuk Cl) -, SRO divalen, dengan 2+ beban untuk Sr, dan dari -2 untuk O (o2-, anion oksida).
Dalam struktur ini setiap ion O2- (merah) dikelilingi oleh enam oksida besar yang lain, hosting dalam interstices octahedral yang dihasilkan ion SR2+ (warna hijau), lebih kecil. Pembungkusan atau susunan ini dikenali sebagai sel kesatuan padu yang berpusat pada muka (CCC).
Jenis pautan
Formula kimia strontium oksida adalah SRO, tetapi tidak benar -benar menjelaskan struktur kimia atau jenis pautan yang ada.
Dalam bahagian sebelumnya ia disebutkan bahawa ia membentangkan struktur garam GEMA; iaitu, struktur kristal yang sangat biasa untuk banyak garam.
Oleh itu, jenis pautan kebanyakannya ionik, yang akan menjelaskan mengapa oksida ini mempunyai gabungan tinggi dan titik mendidih.
Oleh kerana pautannya adalah ionik, ia adalah interaksi elektrostatik yang mengekalkan atom strontium dan oksigen bersama -sama: Sr2+ O2-.
Sekiranya ikatan ini kovalen, sebatian itu boleh diwakili dengan pautan dalam struktur Lewisnya (tidak menghilangkan elektron oksigen yang tidak dikongsi).
Aplikasi
Ciri -ciri fizikal sebatian adalah penting untuk meramalkan apa yang berpotensi aplikasi mereka dalam industri; Oleh itu, ini adalah refleksi makro dari sifat kimianya.
Pengganti utama
Strontium Oxide, terima kasih kepada kestabilan terma yang tinggi, mendapati banyak aplikasi dalam industri seramik, kaca dan optik.
Penggunaannya dalam industri ini terutamanya bertujuan untuk menggantikan plumbum dan menjadi bahan tambahan yang memberikan warna dan kelikatan yang lebih baik kepada bahan mentah produk.
Boleh melayani anda: menyewa halogenuros: sifat, mendapatkan, contohProduk mana? Senarai itu tidak akan berakhir, kerana di mana -mana yang mempunyai kaca, enamel, seramik atau kristal di salah satu kepingannya, strontium oksida mungkin berguna.
Industri Aeroangkasa
Memandangkan ia adalah pepejal yang sangat berliang, ia boleh memintas zarah -zarah yang lebih kecil, dan dengan itu memberikan pelbagai kemungkinan dalam perumusan bahan, sebagai cahaya yang akan dipertimbangkan oleh industri aeroangkasa.
Pemangkin
Keliangan yang sama membolehkan anda mempunyai potensi kegunaan sebagai pemangkin (pemecut tindak balas kimia) dan sebagai penukar haba.
Tujuan elektronik
Strontium oksida juga berfungsi sebagai sumber pengeluaran strban tulen untuk tujuan elektronik, terima kasih kepada keupayaan logam ini untuk menyerap x -rays; Dan untuk penyediaan perindustrian hidroksida, Sr (OH) 2, dan peroksida, Sro2.
Risiko kesihatan
Ia adalah sebatian yang menghakis, jadi ia boleh menyebabkan luka bakar dengan hubungan fizikal yang mudah di mana sahaja di dalam badan. Ia sangat sensitif terhadap kelembapan dan mesti disimpan di ruang kering dan sejuk.
Produk garam tindak balas oksida ini dengan asid yang berlainan berkelakuan dalam badan serta garam kalsium, dan disimpan atau diusir oleh mekanisme yang serupa.
Pada masa itu, strontium oksida dengan sendirinya tidak mewakili risiko kesihatan yang lebih besar.
Rujukan
- Elemen Amerika. (1998-2018). Elemen Amerika. Pulih dari Amerika.com
- Shiver & Atkins. (2008). Kimia bukan organik. Dalam struktur pepejal sederhana (ed keempat., p. 84). MC Graw Hill.
- Atsdr. Pulih dari ASDR: ATSDR.CDC.Gov
- Clark, j. (2009). Chemguide. Pulih dari chemguide.co.UK
- Tiwary, r., Narayan, s., & Pandey, atau. (2007). Penyediaan stontium oksida dari celestit: ulasan. Sains Bahan, 201-211.

