Potassium Yodato (KIO3)
- 2238
- 582
- Delbert Dare
Apa itu Potassium Iodate?
Potassium atau Potassium Yodato Yodato adalah sebatian iodin bukan organik, khususnya garam, yang formula kimianya adalah kio3. Iodin atau iodin, elemen kumpulan halogen (F, Cl, Br, I, AS), mempunyai garam ini bilangan pengoksidaan +5; Inilah sebabnya mengapa ejen pengoksidaan yang kuat. Kio3 Ia memisahkan medium berair untuk membuat ion k+ dan io3-.
Ia disintesis dengan bertindak balas kalium hidroksida dengan asid yodium: hio3(aq) + koh (s) => kio3(aq) + h2Atau (l). Juga, ia boleh disintesis dengan bertindak balas dengan iodin molekul dengan kalium hidroksida: 3i2(s)+6kOH (s) => kio3(aq) + 5ki (aq) + 3h2Atau (l).
Potassium Yodato Properties
 Potassium Yodato penampilan
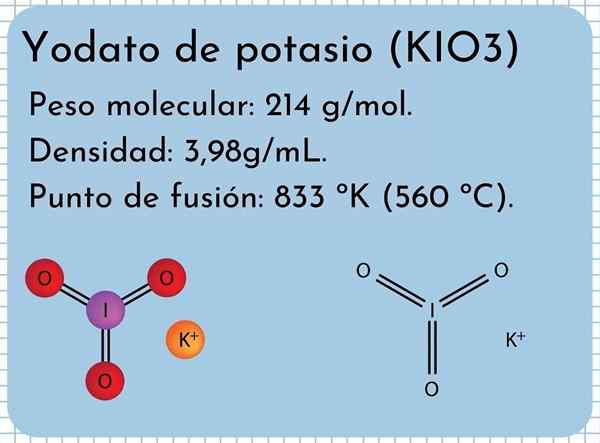
Potassium Yodato penampilan Ia adalah pepejal putih yang tidak berbau, kristal halus dan dengan struktur kristal monoklinik. Ia mempunyai ketumpatan 3.98g/ml, berat molekul 214 g/mol dan membentangkan band penyerapan dalam spektrum inframerah (IR).
Ia mempunyai titik lebur: 833 ºK (560 ºC), yang terdiri daripada interaksi ionik yang kuat antara k ion+ dan io3-. Pada suhu yang lebih tinggi, tindak balas penguraian terma, melepaskan oksigen molekul dan kalium iodida:
2Kio3(s) => 2ki (s) + 3o2(g)
Di dalam air ia mempunyai kelarutan yang berbeza dari 4.74g/100ml hingga 0 ºC, sehingga 32.3 g/100ml pada 100 ºC, menghasilkan penyelesaian berair tanpa warna. Di samping itu, ia tidak larut dalam asid alkohol dan nitrik, tetapi ia larut dalam asid sulfurik yang dicairkan.
Affinity untuk air tidak ketara, yang menjelaskan mengapa ia bukan hygroscopic dan tidak wujud dalam bentuk garam terhidrat (kio3· H2Sama ada).
Ejen pengoksidaan
Potassium Yodato, seperti yang ditunjukkan oleh formula kimianya, mempunyai tiga atom oksigen. Ini adalah elemen elektronegatif yang kuat dan, kerana harta ini, ia meninggalkan "menemui" kekurangan awan elektronik yang mengelilingi yodium.
Boleh melayani anda: gas lengaiKekurangan ini - atau sumbangan, mengikut kes - boleh dikira sebagai bilangan pengoksidaan iodin (± 1, +2, +3, +5, +7), menjadi +5 dalam kes garam ini.
Apakah maksud ini? Bahawa sebelum spesies yang mampu memberikan elektron mereka, iodin akan menerima mereka dalam bentuk ionik mereka (io3-) untuk menjadi yodium molekul dan mempunyai nombor pengoksidaan yang sama dengan 0.
Berikutan penjelasan ini, dapat ditentukan bahawa iodat kalium adalah sebatian pengoksidaan yang bertindak balas dengan ejen pengurangan dalam banyak reaksi redoks; Dari semua ini, seseorang dikenali sebagai jam iodin.
Jam iodin terdiri daripada proses redoks langkah lambat dan cepat, di mana langkah -langkah cepat ditandai dengan penyelesaian kio3 Dalam asid sulfurik yang ditambah kanji. Kemudian, kanji yang dihasilkan dan berlabuh di antara strukturnya spesies i3-- Ia akan menjadikan penyelesaian biru berwarna -warni menjadi biru gelap.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 h+ → 3 i2 + 3 jam2Sama ada
Yo2 + Hso3- + H2O → 2 i- + Hso4- + 2 jam+ (biru gelap kerana kanji)
Struktur kimia
 Struktur kalium yodato
Struktur kalium yodato Dalam imej unggul struktur kimia kalium iodat digambarkan. Anion IO3- Ia diwakili oleh "tripod" sfera merah dan ungu, manakala K ion+ Mereka diwakili oleh sfera ungu.
Tetapi apa maksud tripod ini? Bentuk geometri yang betul dari anion ini sebenarnya adalah piramid trigonal, di mana oksigen membentuk pangkalan segi tiga, dan tork yang tidak dikelilingi titik iodin di tingkat atas, menduduki ruang dan memaksa untuk melipat ke bawah pautan i-o dan dua pautan i = o.
Boleh melayani anda: asid tartarikGeometri molekul ini sepadan dengan hibridisasi SP3 atom pusat iodin; Walau bagaimanapun, perspektif lain menunjukkan bahawa salah satu atom oksigen membentuk pautan ke orbital "d" iodin, sebenarnya menjadi hibridisasi jenis SP3d2 (iodin boleh mempunyai orbital "d" yang memperluaskan lapisan Valencia).
Kristal garam ini boleh mengalami peralihan fasa struktur (pengaturan lain selain monoklinik) sebagai akibat dari keadaan fizikal yang berbeza yang menundukkannya.
Kegunaan dan aplikasi iodat kalium
Penggunaan terapeutik
Potassium Yodato biasanya digunakan untuk mengelakkan pengumpulan radioaktiviti dalam tiroid dalam bentuk 131Saya, ketika isotop ini digunakan dalam menentukan yodium oleh tiroid sebagai komponen operasi kelenjar tiroid.
Begitu juga, kalium yodato digunakan sebagai antiseptik topikal (0.5 %) dalam membran mukus.
Gunakan dalam industri
Ia ditambah kepada makanan haiwan pembiakan sebagai suplemen yodium. Oleh itu, kalium yodato digunakan dalam industri untuk meningkatkan kualiti tepung.
Penggunaan analisis
Dalam kimia analisis, terima kasih kepada kestabilannya, ia digunakan sebagai corak utama dalam penyeragaman corak natrium thiosulfate (NA2S2Sama ada3), dengan tujuan menentukan kepekatan yodium dalam masalah masalah.
Ini bermakna jumlah yodium dapat diketahui oleh teknik volumetrik (darjah). Dalam tindak balas ini, iodat kalium mengoksidakan dengan cepat ke ion iodida i-, Melalui persamaan kimia berikut:
Boleh melayani anda: memimpin asetat: struktur, sifat, mendapatkan, kegunaanIo3- + 5i- + 6H+ => 3i2 + 3h2Sama ada
Iodin, i2, bertajuk dengan penyelesaian NA2S2Sama ada3 untuk penyeragamannya.
Gunakan dalam teknologi laser
Kajian telah menunjukkan dan menyokong sifat optik piezoelektrik, pyroelektrik, elektrooptik, ferroelektrik dan bukan linear yang menarik3. Ini menghasilkan potensi besar dalam bidang elektronik dan dalam teknologi laser untuk bahan yang dibuat dengan sebatian ini.
Risiko kesihatan kalium yodate
Dalam dos yang tinggi, ia dapat menghasilkan kerengsaan dalam mukosa lisan, kulit, mata dan saluran udara.
Eksperimen ketoksikan kalium iodat pada haiwan telah membolehkan kita memerhatikan bahawa pada anjing dengan cepat, pada dos 0.2-0.25 g/kg berat badan, dibekalkan secara lisan, sebatian menyebabkan muntah.
Sekiranya muntah -muntah ini dielakkan, ia menghasilkan haiwan yang memburukkan keadaan mereka, kerana anoreksia dan sebelum kematian diinduksi. Autopsi beliau dibenarkan untuk memerhatikan lesi hati nekrotik, buah pinggang dan mukosa usus.
Oleh kerana kuasa pengoksidaannya, ia mewakili risiko kebakaran apabila ia bersentuhan dengan bahan mudah alih.
Rujukan
- Hari, r., & Underwood, a. Kimia Analisis Kuantitatif (Kelima ed.). Pearson Prentice Hall, P-364.
- Buku Kimia. (2017). Potassium iodate. Diperoleh pada 25 Mac, 2018, dari Buku Kimia: Buku Kimia.com
- Pubchem. (2018). Potassium iodate. Diperoleh pada 25 Mac, 2018, dari Pubchem: Pubchem.NCBI.NLM.NIH.Gov
- Merck. (2018). Potassium Yodato. Diperoleh pada 25 Mac, 2018, dari Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Mekanisme Pengangkutan Caj dan Peralihan Fasa Suhu Rendah di Kio3. J. Phys.: Conf. Menjadi. 423 012036

