Sejarah iodin, sifat, struktur, mendapatkan, risiko, kegunaan

- 4529
- 752
- Ms. Micheal Rippin
Dia iodin Ia adalah elemen bukan metal yang reaktif yang dimiliki oleh kumpulan 17 jadual berkala (halogen) dan diwakili oleh simbol kimia i. Pada dasarnya ia adalah elemen yang terkenal di peringkat popular, dari air iodized, ke hormon tirosin.
Dalam keadaan pepejal, yodium berwarna kelabu gelap dengan kilauan logam (imej yang lebih rendah), mampu menyapu untuk menghasilkan wap ungu yang, ketika mengepam permukaan sejuk, meninggalkan sisa gelap. Banyak dan menarik telah menjadi eksperimen untuk menunjukkan ciri -ciri ini.
 Kristal iodin yang mantap. Sumber: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Kristal iodin yang mantap. Sumber: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Unsur ini diasingkan untuk kali pertama oleh Bernard Curtois pada tahun 1811, sambil memperoleh sebatian yang berfungsi sebagai bahan mentah untuk pembuatan garam garam. Walau bagaimanapun, Curtois tidak mengenal pasti yodium sebagai elemen, merit yang dikongsi oleh Joseph Gay-Lussac dan Humphry Davy. Gay-lussac mengenal pasti elemen sebagai "iode", istilah yang datang dari perkataan Yunani "ioides" yang mana warna violet ditetapkan.
Iodin asas, seperti halogen yang lain, adalah molekul diatomik, dibentuk oleh dua atom yodium yang disatukan oleh ikatan kovalen. Interaksi van der Waals antara molekul iodin adalah yang paling kuat di kalangan halogen. Ini menjelaskan mengapa yodium adalah halogen dengan titik lebur dan mendidih tertinggi. Di samping itu, ia adalah reagen halogen paling sedikit, dan yang kurang elektronegativiti.
Iodin adalah elemen penting yang memerlukan ditelan, kerana ia perlu untuk pertumbuhan badan; otak dan perkembangan mental; Metabolisme secara umum, dll., mengesyorkan pengambilan harian 110 μg/hari.
Kekurangan yodium dalam keadaan janin seseorang dikaitkan dengan kemunculan kretinisme, keadaan yang dicirikan oleh pertumbuhan badan yang perlahan; serta perkembangan mental dan intelektual yang tidak mencukupi, strabismus, dll.
Sementara itu, kekurangan yodium pada usia mana -mana individu dikaitkan dengan kemunculan goiter, yang dicirikan oleh hipertrofi tiroid. The Goiter adalah penyakit endemik, kerana ia terhad kepada kawasan geografi tertentu dengan ciri -ciri makanan sendiri.
[TOC]
Sejarah
Penemuan
Iodin itu ditemui oleh ahli kimia Perancis Bernard Curtois, pada tahun 1811, ketika bekerja dengan bapanya dalam pengeluaran salitre, yang mengharuskan sodium karbonat.
Kompaun ini diasingkan dari rumpai laut yang dikumpulkan di pantai Normandy dan Brittany. Untuk tujuan ini, alga dibakar dan abu dibasuh dengan air, memusnahkan sisa yang terhasil dengan penambahan asid sulfurik.
Pada satu ketika, mungkin disebabkan oleh kesilapan yang kebetulan, Curtois menambah lebihan asid sulfurik dan stim ungu dibentuk yang kristal pada permukaan sejuk, mendepositkan sebagai kristal gelap. Curtois mengesyaki bahawa dia berada di hadapan elemen baru dan memanggilnya "bahan x".
Curtois mendapati bahawa bahan ini apabila dicampur dengan ammonia membentuk pepejal coklat (nitrogen triacuro) yang mengeksploitasi hubungan minimum.
Walau bagaimanapun, Curtois mempunyai batasan untuk meneruskan penyelidikannya dan memutuskan untuk menyampaikan tanda-tanda bahannya kepada Charles Desormes, Nicolas Clément, Joseph Gay-Lussac dan André-Marie Ampère, untuk mendapatkan kerjasamanya.
Kemunculan nama
Pada bulan November 1813, Desormes dan Clément mempublikasikan penemuan curtois. Pada bulan Disember tahun yang sama, Gay-Lussac mengatakan bahawa bahan baru itu boleh menjadi elemen baru, mencadangkan nama "iode" dari perkataan Yunani "ioides", yang ditetapkan untuk Violet.
Sir Humphry Davy, yang menerima sebahagian sampel yang dihantar kepada Ampère oleh Curtois, melakukan eksperimen dengan sampel dan melihat persamaan dengan klorin. Pada bulan Disember 1813, Royal Society of London menyertai pengenalan elemen baru.
Walaupun hujah antara gay-lussac dan Davy mengenai pengenalan yodium timbul, kedua-duanya mengakui bahawa curtois adalah yang pertama telah mengasingkannya. Pada tahun 1839 Curtois Final.
Penggunaan Sejarah
Pada tahun 1839, Louis Daguerre memberikan iodin penggunaan komersil pertamanya, dengan mencipta kaedah untuk menghasilkan imej fotografi yang dipanggil daguerreotypes, dalam lembaran nipis logam.
Pada tahun 1905, ahli patologi Amerika David Marine, menyiasat kekurangan iodin dalam penyakit tertentu dan mencadangkan pengambilannya.
Sifat fizikal dan kimia
Penampilan
 Sublimasi kristal iodin. Sumber: ershova Elizaveta [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Sublimasi kristal iodin. Sumber: ershova Elizaveta [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Kilauan logam kelabu gelap. Apabila ia menyahakamkan wapnya, mereka adalah pewarna ungu (imej unggul).
Berat atom standard
126,904 u
Nombor atom (z)
53
Takat lebur
113.7 ºC
Takat didih
184.3 ºC
Ketumpatan
Suhu ambien: 4,933 g/cm3
Kelarutan
Di dalam air ia larut menyebabkan penyelesaian coklat kepekatan 0.03% hingga 20 ºC.
Kelarutan ini meningkat dengan ketara jika terdapat ion iodida yang telah dibubarkan sebelum ini, sebagai keseimbangan antara saya ditubuhkan- dan saya2 Untuk membentuk spesies anionik i3-, yang diselesaikan lebih baik daripada iodin.
Dalam pelarut organik seperti kloroform, karbon tetraklorida dan karbon disulfida, yodium larut memberikan warna ungu. Ia juga larut dalam sebatian nitrogen, seperti piridin, quinoline dan ammonia, untuk membentuk penyelesaian coklat, sekali lagi.
Perbezaan pewarnaan terletak pada fakta bahawa yodium dibubarkan sebagai molekul yang dilarutkan i2, atau sebagai kompleks pemindahan beban; Yang terakhir muncul ketika mereka berurusan.
Boleh melayani anda: Natrium sulfida (Na2s)Bau
Ekar, menjengkelkan dan ciri. Ambang bau: 90 mg/m3 dan ambang bau yang menjengkelkan: 20 mg/m3.
Pekali partisi oktanol/air
Log p = 2.49
Penguraian
Apabila dia dipanaskan untuk penguraian, dia mengeluarkan asap iodida hidrogen dan beberapa sebatian iodida.
Goo
2.27 cp pada 116 ºC
Triple Point
386.65 k dan 121 kPa
Titik kritikal
819 K dan 11.7 MPa
Haba Fusion
15.52 kJ/mol
Haba pengewapan
41.57 kJ/mol
Kapasiti kalori molar
54.44 j/(mol · k)
Tekanan wap
Iodin mempunyai tekanan stim sederhana dan apabila bekas yang mengandungi dibuka, perlahan -lahan disemai ke stim ungu, menjengkelkan untuk mata, hidung dan tekak.
Nombor pengoksidaan
Nombor pengoksidaan untuk iodin adalah: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) dan +7 (i7+). Dalam semua garam iodida, seperti kes ki, iodin memenuhi bilangan pengoksidaan sebanyak -1, kerana kita mempunyai anion i-.
Iodin memperoleh nombor pengoksidaan positif apabila digabungkan dengan lebih banyak elemen elektronegatif daripada dia; Contohnya, dalam oksida mereka (i2Sama ada5 dan saya4Sama ada9) atau sebatian interhalogened (i-f, i-cl dan i-br).
Elektronegativiti
2.66 pada skala Pauling
Tenaga pengionan
Pertama: 1.008.4 kJ/mol
Kedua: 1.845 kJ/mol
Ketiga: 3.180 kJ/mol
Kekonduksian terma
0.449 w/(m · k)
Resistiviti elektrik
1.39 · 107 Ω · m hingga 0 ºC
Urutan magnet
Diamagnetic
Reaktiviti
Iodin digabungkan dengan kebanyakan logam untuk membentuk iodida, dan juga dengan unsur -unsur bukan logam seperti fosforus dan halogen lain. Ion iodida adalah ejen pengurangan yang kuat, yang secara spontan mengeluarkan elektron. Pengoksidaan iodida menghasilkan pewarna coklat iodin.
Iodin, sebaliknya iodida, adalah ejen pengoksidaan yang lemah; lebih lemah daripada bromin, klorin dan fluorida.
Iodin dengan nombor pengoksidaan +1 boleh digabungkan dengan halogen lain dengan nombor pengoksidaan -1, untuk berasal dari halida iodin; Contohnya: bromida iodin. Ia juga digabungkan dengan hidrogen untuk menyebabkan hidrogen iodida, yang selepas larut dalam air dipanggil asid iarhydic.
Asid yodhorrik adalah asid yang sangat kuat yang mampu membentuk iodida dengan tindak balas dengan logam atau oksida, hidroksida dan karbonatnya. Iodin mempunyai keadaan pengoksidaan +5 dalam asid yodium (HIO3), yang dehidrasi menghasilkan pentoksida iodin (i2Sama ada5).
Struktur dan konfigurasi elektronik
- Atom iodin dan pautan mereka
 Molekul diatomik iodin. Sumber: Benjah-bmm27 melalui Wikipedia.
Molekul diatomik iodin. Sumber: Benjah-bmm27 melalui Wikipedia. Iodin dalam keadaan basalnya terdiri daripada atom yang mempunyai tujuh elektron Valencia, hanya satu yang dapat menyelesaikan oktetnya dan menjadi isolektronik dengan gas xenon mulia. Tujuh elektron ini disusun dalam orbital 5s dan 5p mereka mengikut konfigurasi elektronik mereka:
[KR] 4D10 5s2 5 p5
Oleh itu, atom yang saya tunjukkan kecenderungan yang kuat untuk menghubungkan kovalen sehingga masing -masing secara individu mempunyai lapan elektron di lapisan paling luarnya. Oleh itu, dua atom saya mendekati dan membentuk pautan I-I, yang mentakrifkan molekul diatomik i2 (imej unggul); Unit molekul iodin dalam tiga keadaan fizikalnya dalam keadaan biasa.
Dalam gambar molekul saya diperhatikan2 diwakili oleh model pengisian ruang. Bukan sahaja molekul diatomik, tetapi juga homonuklear dan apolar; Jadi interaksi intermolecularnya (i2 - Yo2) Mereka ditadbir oleh pasukan penyebaran London, yang berkadar terus dengan jisim molekul dan saiz atom mereka.
Walau bagaimanapun, pautan I-I ini lebih lemah berbanding halogen lain (F-F, CL-CL dan BR-BR). Ini disebabkan oleh teori kepada tumpang tindih miskin dari SPO3.
- Kristal
Jisim molekul i2 Ia membolehkan daya penyebarannya cukup arah dan kuat untuk menubuhkan kaca ortorrombik pada tekanan ambien. Kandungan elektron yang tinggi menjadikan cahaya menggalakkan simfin peralihan tenaga, yang menghasilkan kristal iodin.
Walau bagaimanapun, apabila iodin menyahakamkan wapnya mempamerkan pewarnaan violet. Ini sudah menunjukkan peralihan yang lebih spesifik dalam orbital molekul i2 (Mereka yang mempunyai tenaga yang lebih besar atau Antienlace).
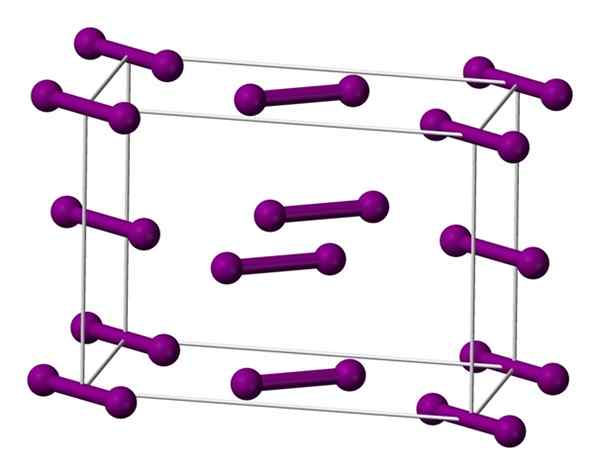 Sel ortorrombik bersatu berpusat di pangkalan untuk kristal iodin. Sumber: Benjah-bmm27 [domain awam].
Sel ortorrombik bersatu berpusat di pangkalan untuk kristal iodin. Sumber: Benjah-bmm27 [domain awam]. Molekul saya ditunjukkan di atas2, diwakili oleh model sfera dan bar, diperintahkan di dalam sel ortorrombik.
Dapat diperhatikan bahawa terdapat dua lapisan: di bawah dengan lima molekul, dan medium dengan empat. Perhatikan bahawa molekul iodin terletak di pangkal sel. Kristal dibina secara berkala lapisan ini dalam tiga dimensi.
Melawat arah selari dengan pautan I-I, didapati bahawa orbital iodin bertindih untuk menjana band memandu, yang kembali ke elemen ini semikonduktor; Walau bagaimanapun, keupayaannya untuk menjalankan elektrik hilang jika arah tegak lurus ke lapisan diikuti.
Jarak pautan
Pautan I-I nampaknya telah ditangguhkan; Dan sebenarnya, kerana panjang pautannya meningkat dari 266 petang (keadaan gas), 272 petang (keadaan pepejal).
Ini mungkin disebabkan oleh fakta bahawa dalam gas molekul i2 Mereka sangat menjauhkan diri, daya intermolecular mereka hampir boleh diabaikan; Semasa berada di pepejal, daya ini (I-I-i-i) menjadi ketara, menarik atom iodin dua molekul jiran ke arah diri mereka dan mengikut jarak intermolecular (atau interatomik, jika tidak dilihat).
Ia dapat melayani anda: Hubungan Kimia dengan Sains LainKemudian, apabila kaca iodin sublimal, kontrak ikatan I-I dalam fasa gas, sebagai molekul jiran tidak lagi menimbulkan daya tarikan yang sama (dispersif) ke atas persekitarannya. Dan juga, secara logiknya, jarak i2 - Yo2 kenaikan.
- Fasa
Disebutkan di atas bahawa pautan i-i lebih lemah berbanding halogen yang lain. Dalam fasa gas pada suhu 575 ºC, 1% daripada molekul i2 Mereka hancur menjadi individu dan atom. Terdapat banyak tenaga terma yang hanya dua dan semula yang dipisahkan, dan sebagainya.
Begitu juga, pemecahan pautan ini boleh berlaku jika tekanan besar pada kristal iodin digunakan. Apabila memampatkannya terlalu banyak (di bawah tekanan beratus -ratus ribu kali lebih tinggi daripada atmosfera), molekul i2 Mereka disusun semula sebagai fasa monoatomik I, dan kemudian dikatakan bahawa iodin mempamerkan ciri -ciri logam.
Walau bagaimanapun, terdapat fasa kristal lain, seperti: Ortrome -Centered Orthome.
Di mana dan dapatkan
Iodin mempunyai bahagian berat, berhubung dengan kerak bumi, 0.46 ppm, menduduki tempat 61 yang banyak di dalamnya. Mineral Yoduro adalah kekurangan, dan deposit yodin yang boleh dieksploitasi secara komersial adalah yodatos.
Mineral iodin mendapati di batu igneus dengan kepekatan 0.02 mg/kg pada 1.2 mg/kg, dan dalam batu magmatic dengan kepekatan 0.02 mg pada 1.9 mg/kg. Ia juga boleh didapati di lutita Kimmeridge, dengan kepekatan 17 mg/kg berat.
Di samping itu, mineral iodin terdapat dalam batuan fosfat dengan kepekatan antara 0.8 dan 130 mg/kg. Air laut mempunyai kepekatan iodin yang berbeza dari 0.1 hingga 18 μg/l. Alga, spons dan tiram laut dahulunya sumber utama iodin.
Walau bagaimanapun, sumber -sumber utama adalah caliche, deposit natrium nitrat di padang pasir Atacama (Chile), dan Salmuelas, terutamanya di lapangan gas Jepun di Minami Kanto, timur Tokyo, dan lembangan gas Anadarko di Oklahoma (Amerika Syarikat di Oklahoma (Amerika Syarikat di Oklahoma (USA ).
Caliche
Iodin diekstrak dari iodinus caliche dan dirawat dengan natrium bisulfite untuk mengurangkannya ke iodida. Kemudian, penyelesaiannya bertindak balas dengan Yodato yang baru diekstrak untuk memudahkan penapisannya. Caliche adalah sumber utama yodium pada abad kesembilan belas dan awal abad kedua puluh.
Air garam
Selepas pemurniannya, air garam dirawat dengan asid sulfurik, yang menghasilkan iodida.
Penyelesaian iodida ini kemudiannya bertindak balas dengan klorin untuk menghasilkan larutan iodin yang dicairkan, yang menguap melalui arus udara yang menyimpang ke menara penyerap sulfur dioksida, menghasilkan reaksi berikut:
Yo2 + 2 jam2Atau +begitu2 => 2 hi +h2SW4
Selepas itu, gas iodida hidrogen bertindak balas dengan klorin untuk melepaskan yodium dalam keadaan gas:
2 hi +cl2 => I2 + 2 HCl
Dan akhirnya, penapis iodin, membersihkan dan pembungkusan untuk digunakan.
Kertas Biologi
- Diet yang disyorkan
Iodin adalah elemen penting, kerana ia campur tangan dalam pelbagai fungsi dalam makhluk hidup, yang terutama dikenali pada manusia. Satu -satunya cara kemasukan yodium kepada manusia adalah makanan yang dia ingests.
Diet iodin yang disyorkan berbeza dengan usia. Oleh itu, budak lelaki 6 bulan -bulan memerlukan pengambilan 110 μg/hari; Tetapi dari usia 14 tahun, diet yang disyorkan adalah 150 μg/hari. Di samping itu, diperhatikan bahawa pengambilan iodin tidak boleh melebihi 1.100 μg/hari.
- Hormon tiroid
Hormon merangsang tiroid (TSH) dirembeskan oleh pituitari dan merangsang yodium dengan folikel tiroid. Iodin dibawa ke dalam folikel tiroid, yang dikenali sebagai koloid, di mana ia mengikat pada tirosin asid amino untuk membentuk monoyodothyrosine dan diiodothyrosine.
Dalam koloid folikel, monoyodirosin3). Sebaliknya, dua molekul diiodothyrosine dapat bergabung, membentuk tetrarydotyron (t4). T3 dan t4 Mereka adalah hormon tiroid.
Hormon t3 dan t4 Mereka dirembeskan ke plasma di mana mereka mengikat protein plasma; Antaranya protein penghantar hormon tiroid (TBG). Kebanyakan hormon tiroid diangkut dalam plasma sebagai t4.
Walau bagaimanapun, bentuk aktif hormon tiroid adalah t3, Jadi t4 Dalam "organ putih" hormon tiroid, pengalaman dan berubah menjadi t3 Untuk melaksanakan tindakan hormon anda.
Kesan
Kesan tindakan hormon tiroid adalah pelbagai, dapat menunjukkan perkara berikut: peningkatan metabolisme dan sintesis protein; promosi pertumbuhan badan dan perkembangan otak; Peningkatan tekanan darah dan kadar denyutan jantung, dll.
- Kekurangan
Kekurangan iodin dan, oleh itu, hormon tiroid, yang dikenali sebagai hipotiroidisme, mempunyai banyak akibat yang dipengaruhi oleh usia seseorang.
Sekiranya kekurangan iodin berlaku semasa keadaan janin seseorang, akibat yang paling relevan adalah kreatinisme. Keadaan ini dicirikan oleh tanda -tanda seperti kemerosotan fungsi mental, kelewatan perkembangan fizikal, strudisme dan pematangan seksual lewat.
Boleh melayani anda: Tembaga: Sejarah, Hartanah, Struktur, Kegunaan, Kertas BiologiKekurangan iodin boleh menyebabkan goiter, tanpa mengira usia di mana kekurangan berlaku. Goiter adalah perkembangan tiroid yang berlebihan, yang disebabkan oleh rangsangan kelenjar yang berlebihan oleh hormon TSH, yang dibebaskan dari kelenjar pituitari akibat kekurangan yodium.
Saiz tiroid yang berlebihan (goiter) dapat memampatkan trakea, mengehadkan laluan udara melaluinya. Di samping itu, ia boleh menyebabkan kerosakan pada saraf laryngeal yang boleh menjadi rum.
Risiko
Keracunan akibat pengambilan iodin yang berlebihan boleh menyebabkan luka bakar di mulut, tekak dan demam. Juga sakit perut, loya, muntah, cirit -birit, nadi lemah dan koma.
Lebih banyak iodin menghasilkan beberapa gejala yang diperhatikan dalam kekurangan: terdapat perencatan sintesis hormon tiroid, jadi pembebasan TSH meningkat, yang mengakibatkan hipertrofi tiroid; iaitu goiter.
Terdapat kajian yang menunjukkan bahawa pengambilan iodin yang berlebihan boleh menyebabkan kanser papillary tiroid. Di samping itu, pengambilan iodin yang berlebihan dapat berinteraksi dengan ubat -ubatan dengan mengehadkan tindakannya.
Pengambilan iodin yang berlebihan dengan ubat antithyroid, seperti metimazole, yang digunakan untuk merawat hipertiroidisme, boleh mempunyai kesan tambahan dan menyebabkan hipotiroidisme.
Angiotensin (ECA) menukarkan inhibitor enzim, seperti benazepril, digunakan dalam rawatan hipertensi. Mengambil jumlah kalium iodida yang berlebihan meningkatkan risiko hiperkalemia dan hipertensi.
Aplikasi
Doktor
Iodin bertindak sebagai pembasmi kuman kulit atau luka. Ia mempunyai hampir tindakan antimikrob, menembusi mikroorganisma dan berinteraksi dengan asid amino sulfur, nukleotid dan asid lemak, yang menyebabkan kematian sel.
Ia menimbulkan tindakan antiviral pada asasnya pada virus yang dilindungi, menyiarkan yang menyerang permukaan virus yang dilindungi.
Potassium iodida dalam larutan pekat, digunakan dalam rawatan thyrotoxicosis. Ia juga digunakan untuk mengawal kesan sinaran 131Saya Semasa menyekat kesatuan isotop radioaktif ke tiroid.
Iodin digunakan dalam rawatan keratitis dendritik. Untuk ini, kornea ke wap air tepu dengan iodin terdedah, epitel kornea itu hilang sementara; Tetapi ada pemulihan sepenuhnya dalam dua atau tiga hari.
Iodin juga mempunyai kesan yang baik terhadap rawatan fibrosis sinus manusia. Begitu juga, telah menunjukkan bahawa 131Saya boleh menjadi rawatan kanser tiroid pilihan.
Tindak balas dan tindakan pemangkin
Iodin digunakan untuk mengesan kehadiran kanji, memberikan warna biru. Reaksi yodium dengan kanji juga digunakan untuk mengesan kehadiran tiket palsu yang dicetak di atas kertas yang mengandungi kanji.
Potassium (II) Tetrayodomercurate, juga dikenali sebagai Reagen Nessler, digunakan dalam pengesanan ammonia. Begitu juga, larutan iodin alkali digunakan dalam ujian iodoform, untuk menunjukkan kehadiran metilketonus.
Iodida anorganik. Pada peringkat proses, tetrayoduros logam ini mesti dibentuk.
Iodin berfungsi sebagai penstabil untuk produk Colfonia, minyak dan kayu lain.
Iodin digunakan sebagai pemangkin dalam tindak balas sintesis organik metilasi, isomerisasi dan dehidrogenasi. Sementara itu, asid iarchloric digunakan sebagai pemangkin untuk pengeluaran asid asetik dalam proses monsanto dan kativa.
Iodin bertindak sebagai pemangkin dalam pemeluwapan dan alposasi amina aromatik, serta dalam proses sulfatisasi dan sulfanasi, dan untuk pengeluaran karet sintetik.
Fotografi dan optik
Silver Yoduro adalah komponen penting dalam filem fotografi tradisional. Iodin digunakan dalam pembuatan instrumen elektronik seperti prisma kaca unik, instrumen optik polarisasi, dan kaca yang mampu menghantar sinar inframerah.
Kegunaan lain
Iodin digunakan dalam penjelasan racun perosak, pewarna aniline dan phtaleína. Di samping itu, ia digunakan dalam sintesis pewarna, dan merupakan ejen pemadam asap. Dan akhirnya, iodida perak berfungsi sebagai teras pemeluwapan wap air di awan, untuk menyebabkan hujan.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Stuart Ira Fox. (2003). Fisiologi Manusia. Edisi pertama. Edit. McGraw-Hill Inter-American
- Wikipedia. (2019). Iodin. Diperoleh dari: dalam.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Struptur modulated iodin pepejal semasa pemisahan molekul STI und. Jilid Alam 423, Pages971-974. doi.org/10.1038/Nature01724
- Chen l. et al. (1994). Peralihan fasa struktur yodium pada tekanan tinggi. Institut Fizik, Akademi Sinica, Beijing. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26 Ogos 2019). Iodin. Encyclopædia Britannica. Pulih dari: Britannica.com
- Dr. Doug Stewart. (2019). Fakta elemen iodin. Chemicool. Pulih dari: chemicool.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Iodin. Pangkalan data PUBCHEM. CID = 807. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Rohner, f., Zimmermann, m., Jooste, ms., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarker Pemakanan untuk Kajian Pembangunan-Iodin. Jurnal Pemakanan, 144 (8), 1322S-1342S. Doi: 10.3945/Jn.113.181974
- Advameg. (2019). Iodin. Kimia dijelaskan. Pulih dari: kimiaExplaed.com
- Traci Pedersen. (19 April 2017). Fakta mengenai iodin. Pulih dari: Livescience.com
- Megan Ware, RDN, LD. (30 Mei 2017). Semua yang anda perlu tahu mengenai iodin. Pulih dari: MedicalNewStody.com
- Institut Kesihatan Kebangsaan. (9 Julai 2019). Iodin. Diperolehi dari: SDG.OD.NIH.Gov

