Struktur, sifat Berkelio (BK), memperoleh, menggunakan

- 3215
- 730
- Mr. Tracy Parisian
Dia Berkelium Ia adalah elemen kimia yang simbolnya adalah bk. Ia tergolong dalam kelas actinids, yang menjadi ahli kelapannya. Nombor atom anda ialah 97. Ia adalah pepejal logam sintetik. Elemen ini tidak dijumpai secara semula jadi di atas kerak bumi. Ia terdapat dalam kuantiti yang kecil dalam bahan api nuklear yang dibelanjakan dan mempunyai bersinar perak.
Terdapat juga jumlah kecil yang tersebar di alam sekitar kerana ujian senjata nuklear, disebabkan oleh kemalangan yang serius dalam kemudahan tenaga atom seperti chernobyl dan oleh pembebasan yang berlaku dari sisa dari loji tenaga nuklear.
 Simbol, nombor dan jisim atom unsur Berkelio. Sumber: ME/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/2.5). Sumber: Wikimedia Commons.
Simbol, nombor dan jisim atom unsur Berkelio. Sumber: ME/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/2.5). Sumber: Wikimedia Commons. Utiliti praktikal untuk Berkelio belum dijumpai, kerana ia berlaku dalam kuantiti yang sangat kecil dan fakta bahawa semua isotopnya (atom BK dengan bilangan neutron yang berlainan dalam nukleus) adalah radioaktif. Permohonan utamanya adalah dalam kajian saintifik.
Walaupun isotop mereka dihasilkan secara buatan di makmal khas dan dikendalikan oleh kakitangan pakar, ganti rugi yang diperoleh radiasi berbahaya harus selalu diambil kira.
[TOC]
Nomenclature
- Berkelio, simbol BK.
- Berkelio-243, BK-243 atau 243BK: Isotop Berkelio dengan jisim atom 243.
Penemuan
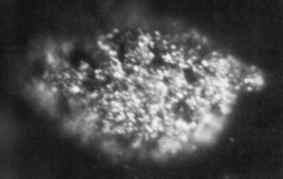 1.7 Mikrogram mikrofotografi Berkelio logam pepejal diperoleh pada tahun 1969. Makmal Kebangsaan Oak Ridge, Jabatan Tenaga / Domain Awam AS. Sumber: Wikimedia Commons.
1.7 Mikrogram mikrofotografi Berkelio logam pepejal diperoleh pada tahun 1969. Makmal Kebangsaan Oak Ridge, Jabatan Tenaga / Domain Awam AS. Sumber: Wikimedia Commons. Ia pertama kali dihasilkan pada tahun 1949 oleh saintis Glen Seaborg, Stanley G. Thompson dan Al Ghiorso di Berkeley University di California, ketika mereka membombardir Amerio-241 dengan zarah alfa bertenaga tinggi menggunakan siklotron (pemecut zarah).
Sejurus selepas penyinaran bahan dibubarkan dengan betul dan dilalui melalui lajur resin pertukaran ion, menggunakan penyelesaian ammonium sitrat sebagai eluen.
Dengan cara ini mereka memperoleh isotop nombor unsur 97 dengan 243 jisim atom, yang memancarkan zarah alfa dan mempunyai separuh hayat 4.5 jam.
Nama elemen
Pada mulanya beberapa penyelidik mencadangkan bahawa elemen mengambil nama salah satu penemunya, Glen Seaborg, kerana dia mempunyai merit yang berjaya mensintesis 10 elemen dalam beberapa tahun kerja.
Boleh melayani anda: BeakerWalau bagaimanapun, organisasi rasmi Kesatuan Antarabangsa Kimia Pure dan Gunaan atau IUPAC (akronim untuk Bahasa Inggeris Kesatuan Antarabangsa Kimia Tulen dan Gunaan) memutuskan untuk memberikan nama "Berkelio" kerana telah diperoleh di Universiti dan bandar Berkeley (California).
 Kemunculan kawasan Universiti Berkeley, Califronia. Pengarang: Sarangib. Sumber: Pixabay.
Kemunculan kawasan Universiti Berkeley, Califronia. Pengarang: Sarangib. Sumber: Pixabay. Nama Berkeley berasal dari ahli falsafah Angloirlandés George Barkeley, nama yang sebutannya kemudian berubah di Amerika Syarikat ketika kota dan universiti ditubuhkan pada tahun 1869.
Itu secara santai adalah tahun yang Dmitri Mendeléyev menerbitkan jadual berkala pertamanya dan mula meramalkan kewujudan unsur -unsur baru seperti Berkelio.
Struktur elektronik
Konfigurasi elektroniknya ialah:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10 4F14; 5s2 5p6 5d10; 6s2 6p6; 5F9 7s2,
atau padat:
[RN] 5F9 7s2.
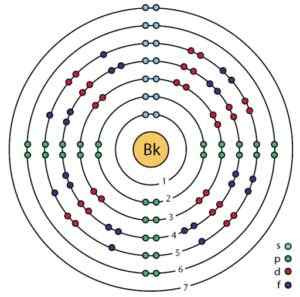 Struktur elektronik Berkelio. Orbital dan elektron dapat dilihat. Ahazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Struktur elektronik Berkelio. Orbital dan elektron dapat dilihat. Ahazard.ScienceWriter/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Memperoleh
Sampel pertama logam disediakan pada tahun 1969 melalui tindak balas pengurangan fluorida (BKF3) Dengan logam litium (li) pada suhu 1300 k.
Untuk menyediakan lembaran logam nipis, bko oksida dikurangkan2 Dengan torio (th) atau logam lantano.
Sifat fizikal Berkelio
Keadaan fizikal
Pepejal logam silled.
Logam Berkelio mempunyai dua bentuk kristal: Alpha (Hexagon Double Compact) dan Beta (padu berpusat di wajah).
Jisim atom
247
Takat lebur
1050 ºC (bentuk alpha)
986 ° C (bentuk beta)
Takat didih
2627 ºC
Ketumpatan
14.78 g/cm3 (Borang Alpha)
13.25 g/cm3 (borang beta)
Paramagnetism
Menurut beberapa sumber beberapa sebatian Berkelio menunjukkan sifat paramagnetik, yang bermaksud bahawa mereka tertarik dengan medan magnet.
Ciri ini adalah jenis paramagnetik kerana apabila menggantung tindakan magnetik, bahan gagal mengekalkan sifat tersebut sahaja.
Sifat kimia
Pada suhu tinggi, Berkelio logam cepat dioksidakan di udara atau oksigen, membentuk oksida. Ia mudah larut dalam asid mineral, melepaskan gas hidrogen h2 dan membentuk ion bk3+.
Boleh melayani anda: aluminium hidrida (ALH3): struktur, sifat, kegunaanKeadaan pengoksidaan
Penyiasatan awal elemen ini terhad kepada pertukaran ion dan eksperimen coprecipitation, yang mana ia diperhatikan bahawa keadaan pengoksidaan +3 stabil dan +4 boleh diakses dalam larutan akueus, kerana BK3+ Ia boleh dioksidakan oleh ion bromato (bro4-) Untuk memberi bk4+.
Penstabilan BK4+
Pada tahun 2017 penstabilan BK dilaporkan4+ Dalam penyelesaian menggunakan sebatian yang dibentuk oleh kumpulan hydroxipiridinone bersatu dengan struktur poliamin (dipanggil ligand 3,4,3-LI (1,2-hop)).
Kompaun ini mempunyai lapan tempat di mana ion bergabung, yang sesuai dengan atom oksigen kumpulan c = o dan n-oh, meninggalkan bk4+ dikaitkan dengan ligan, stabil stabil.
Sebatian pepejal
BK4+ Bolehkah Coprecipitate dengan Cerio (CE4+) atau zirkonium (zr4+) dalam fosfat atau yodato. Ia juga boleh diekstrak dalam penyelesaian heksana heksana (2-etilhexil) hidrogenofosfat atau ejen yang serupa.
Kompaun Berkelio pertama yang berlaku dalam kuantiti yang kelihatan adalah klorida (BKCL3), dari mana 0.00000000003 gram diperoleh pada tahun 1962. Sejak itu beberapa sebatian Berkelio dapat menyediakan dan belajar.
Mereka boleh disebut sebagai contoh fosfat (BKPO4), oxychloride (BKOCL), fluorida (BKF3 dan BKF4), Dioksida (BKO2), trioksida (bk2Sama ada3), Yodatos (bk (io3)3 dan bk (io3)4), Chlorohydrate [bkcl2(H2Sama ada)6] CL, oxalate, sebatian organomethalic dan sebatian koordinasi, antara lain.
Keadaan pengoksidaan baru +5
Pada tahun 2018, sekumpulan penyiasat dari beberapa negara berjaya menghasilkan kompleks nitrat dengan penkelio pentavalent (BK5+) yang formulanya adalah bko2(Tidak3)2-, dengan menghapuskan dua molekul2 daripada bk ion (tidak3)4-, (Bk3+).
Pengiraan Tenaga Komputasi mengesahkan bahawa keadaan pengoksidaan +5 adalah yang mempunyai kestabilan terbesar dalam kompleks nitrat Berkenilo ini, oleh itu kemungkinan besar.
Isotop
Dari Berkelio, 14 isotop dengan massa atom telah disintesis dari 238 hingga 251. Semua radioaktif.
Ia boleh melayani anda: Benchilo: Benzyl Hydrogens, Carbocations, Benzyl RadicalsYang paling stabil ialah Berkelio-247, yang separuh hayatnya adalah 1380 tahun. Setiap atom isotop ini apabila hancur memancarkan zarah alfa dan membentuk atom Amerika-243.
BK-249 mempunyai separuh hayat 330 hari, mengalami kerosakan beta dan menjadi Californio-249.
Aplikasi
Oleh kerana mereka hanya dapat memperoleh sejumlah kecil elemen ini, ia hanya digunakan dalam penyelidikan saintifik asas.
Dalam mendapatkan unsur yang lebih berat
Isotop BK-249 mempunyai separuh hayat yang agak panjang dan mungkin.
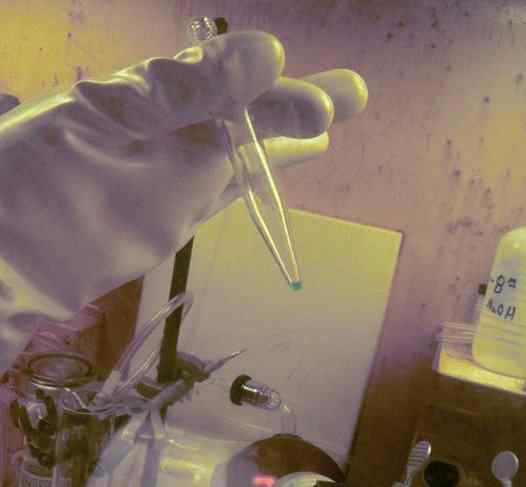 Mikrokantiti BK dibubarkan dalam tiub ujian. 250 hari digunakan untuk mendapatkannya. Sarung tangan perlindungan radioaktiviti elemen ini dapat diperhatikan. ORNL, Jabatan Tenaga / Domain Awam. Sumber: Wikimedia Commons.
Mikrokantiti BK dibubarkan dalam tiub ujian. 250 hari digunakan untuk mendapatkannya. Sarung tangan perlindungan radioaktiviti elemen ini dapat diperhatikan. ORNL, Jabatan Tenaga / Domain Awam. Sumber: Wikimedia Commons. Dalam kajian fizikokimia
Penyelidikan yang dijalankan dengan BK membolehkan ekstrapolasi yang lebih tepat mengenai sifat -sifat dan tingkah laku unsur -unsur lain yang mengikuti siri bertindak, kerana unsur -unsur paling berat lebih sukar diperolehi, mereka mempunyai kehidupan purata yang sangat singkat dan lebih banyak radioaktif.
Risiko
Berkelio adalah elemen radioaktif. Pelepasan radioaktiviti di alam sekitar dapat mencapai semua spesies haiwan dan tumbuh -tumbuhan yang menyebabkan kerosakan kepada mereka. Kemerosotan dapat berkumpul pada generasi berturut -turut.
 Tumbuhan tenaga nuklear adalah radioaktif dan oleh itu sangat berbahaya. Pengarang: AR130405. Sumber: Pixabay.
Tumbuhan tenaga nuklear adalah radioaktif dan oleh itu sangat berbahaya. Pengarang: AR130405. Sumber: Pixabay. Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Berkelium - BK (elemen). Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Putih, f.D. et al. (2019). Kimia Kontemporari Berkelium dan Californium. Kimia 2019 6 Ogos; 25 (44): 10251-10261. Pulih dari PubMed.NCBI.NLM.NIH.Gov.
- Memimpin, d.R. (Editor) (2003). Buku Panduan Kimia dan Fizik CRC. 85th CRC Press.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Kelley, m.P. et al. (2018). Bond Covalecy dan Pengoksidaan Keadaan Actinide INS dikompleks dengan ejen chelating terapeutik 3,4,3-LI (1,2-hopo). Inorg. Chem. 2018 7 Mei; 57 (9): 5352-5363. Pulih dari PubMed.NCBI.NLM.NIH.Gov.
- Kovács, a. et al. (2018). Pentavalent Curium, Berkelium, dan Californium dalam Kompleks Nitrat: Memperluas Kimia dan Pengoksidaan Actinide. Chem. 2018 6 Ogos; 57 (15): 9453-9467. Pulih dari PubMed.NCBI.NLM.NIH.Gov.
- Orlova, a.Yo. (2007). Kimia dan kimia struktur anhydrous tri-totravalent actophosphers. Dalam kimia struktur sebatian actinide bukan organik. Pulih dari Scientedirect.com.
- Choppin, g. et al. (2013). Elemen actinide dan transactinide. Dalam Radiokimia dan Kimia Nuklear (Edisi Keempat). Pulih dari Scientedirect.com.
- Peterson, j.R. dan Hobart, D.Dan. (1984). Kimia Berkelium. Kemajuan Kimia Bukan Organik, Jilid 28, 1984, halaman 29-72. Pulih dari Scientedirect.com.
- Persatuan Kimia Diraja. (2020). Berkelium. RSC pulih.org.

