Bahagian sel galvanik, bagaimana kerja, aplikasi, contoh

- 977
- 133
- Clarence Greenholt DDS
The Sel galvanik O Voltan Sel adalah sejenis sel elektrokimia yang terdiri daripada dua logam yang berbeza yang direndam dalam dua separa -llads, di mana sebatian dalam larutan aktif adalah tindak balas spontan.
Kemudian, salah satu logam di salah satu daripada separa -llads dioksidakan manakala logam semi -media yang lain dikurangkan, menghasilkan pertukaran elektron melalui litar luaran. Ini membolehkan untuk memanfaatkan arus elektrik.
 Rajah 1. Skim dan bahagian sel galvanik. Sumber: Corinth.Pucp.Edu.PE.
Rajah 1. Skim dan bahagian sel galvanik. Sumber: Corinth.Pucp.Edu.PE. Nama "Galvanic Cell" adalah untuk menghormati salah satu perintis eksperimen dengan elektrik: Doktor dan ahli fisiologi Itali Luigi Galvani (1737-1798).
Galvani ditemui pada tahun 1780 bahawa jika mereka bergabung dengan satu kabel akhir logam yang berlainan dan hujung bebas disentuh dengan ANCA dari katak (mati), maka penguncupan berlaku.
Walau bagaimanapun, yang pertama membina sel elektrokimia untuk menghasilkan elektrik juga adalah Alessandro Volta Itali (1745-1827) pada tahun 1800 dan oleh itu nama alternatif sel voltan.
Bahagian sel galvanik
Bahagian sel galvanik ditunjukkan dalam Rajah 1 dan yang berikut:
1.- Anodic Semi -media
2.- Elektrod anodium
3.- Penyelesaian anodik
4.- Katodik Semi -Media
5.- Elektrod katodik
6.- Penyelesaian katodik
7.- Jambatan Saline
8.- Konduktor logam
9.- Voltmeter
Berfungsi
Untuk menerangkan fungsi sel galvanik kita akan bergantung pada yang lebih rendah:
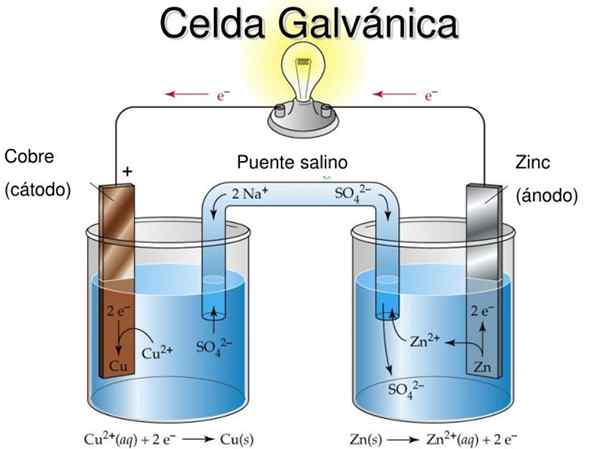 Rajah 2. Model didaktik sel galvanik. Sumber: SlideServe.com
Rajah 2. Model didaktik sel galvanik. Sumber: SlideServe.com Idea asas sel galvanik adalah bahawa logam yang dialami oleh tindak balas pengoksidaan secara fizikal dipisahkan dari logam yang dikurangkan, sehingga pertukaran elektron terjadi melalui konduktor luaran yang membolehkan memanfaatkan aliran arus elektrik , Sebagai contoh untuk menyalakan mentol atau LED.
Dalam Rajah 2 di separuh -duri di sebelah kiri anda mempunyai pita tembaga logam (CU) yang direndam dalam larutan sulfat tembaga (CUS04), Sementara di separuh kanan terdapat pita zink (Zn) yang direndam dalam larutan zink sulfat (ZnSO4).
Harus diingat bahawa dalam setiap separuh -duri logam masing -masing terdapat dalam dua keadaan pengoksidaan: atom logam neutral dan ion logam garam logam yang sama dalam larutan.
Sekiranya pita logam tidak dihubungkan dengan kabel konduktif luaran, maka kedua -dua logam mengoksidakan secara berasingan di sel masing -masing.
Walau bagaimanapun, apabila ia disambungkan secara elektrik, pengoksidaan akan berlaku di Zn sementara akan ada tindak balas pengurangan dalam CU. Ini kerana tahap pengoksidaan zink lebih besar daripada tembaga.
Logam yang mengoksidakan hasil kepada logam yang dikurangkan melalui konduktor luar dan aliran semasa ini boleh digunakan.
Boleh melayani anda: derivatif halogenasiTindak balas pengoksidaan dan pengurangan
Reaksi yang berlaku di sebelah kanan antara elektrod logam zink dan larutan zink sulfat berair adalah seperti berikut:
ZnSama ada(S) + Zn2+ (SW4)2- → 2 Zn2+(Ac) + (SW4)2- + 2 e-
Atom zink (pepejal) di permukaan elektrod anodik di separuh kanan, dirangsang oleh ion positif zink dalam larutan, menghasilkan dua elektron dan muncul dari elektrod, pergi ke larutan akueus Sebagai ion zink yang positif.
Kami menyedari bahawa hasil bersih adalah bahawa atom zink logam neutral, dengan kehilangan dua elektron, menjadi ion zink yang menambah larutan akueus, sehingga bar zink kehilangan atom dan penyelesaiannya memperoleh ion ganda positif.
Elektron yang dibebaskan akan lebih suka bergerak melalui kabel luaran ke arah logam semi -media yang lain dengan beban positif (Cartodo +). Bar zink kehilangan jisim sejak atomnya secara beransur -ansur lulus ke penyelesaian berair.
Pengoksidaan zink boleh diringkaskan seperti berikut:
ZnSama ada(S) → Zn2+(Ac) + 2 e-
Reaksi yang berlaku di sebelah kiri adalah sama, tetapi tembaga larutan berair menangkap dua elektron (berasal dari separuh lain) dan disimpan dalam elektrod tembaga. Apabila atom menangkap elektron, dikatakan dikurangkan.
Reaksi pengurangan tembaga ditulis seperti ini:
Cu2+(Ac) + 2 e- → CuSama ada(S)
Bar tembaga semakin mendapat doh, kerana ion penyelesaian lulus ke bar.
Pengoksidaan berlaku dalam anod (negatif), yang menangkis elektron, sementara pengurangan berlaku dalam katod (positif), yang menarik elektron. Pertukaran elektron berlaku melalui pemacu luaran.
Jambatan Saline
Jambatan Saline mengimbangi beban yang terkumpul di dua separuh. Dalam ion positif separuh anodik berkumpul, sementara dalam katodik terdapat lebihan ion sulfat negatif.
Untuk jambatan salin larutan garam (seperti natrium klorida atau kalium klorida) digunakan yang tidak campur tangan dalam tindak balas, yang berada di dalam tiub berbentuk U -terbalik dengan hujungnya dipasang dengan dinding bahan berliang.
Satu -satunya tujuan jambatan salin adalah untuk ion ditapis ke setiap sel mengimbangi atau meneutralkan beban berlebihan. Oleh itu, melalui jambatan garam terdapat aliran semasa, melalui ion salin, yang menutup litar elektrik.
Potensi pengoksidaan dan pengurangan
Potensi pengoksidaan dan pengurangan standard difahami.
Ia boleh melayani anda: scandio: sejarah, sifat, tindak balas, risiko dan kegunaanUntuk zink potensi pengoksidaan standardnya adalahlembu = +0.76 v. Sementara itu, potensi pengurangan standard untuk tembaga adalah dangrid = +0.34 v. Daya elektromotif (FEM) yang dihasilkan oleh sel galvanik ini ialah: FEM = +0.76 V + 0.34 V = 1.1 V.
Reaksi global sel galvanik boleh ditulis seperti ini:
ZnSama ada(S) + Cu2+(Ac) → Zn2+(Ac) + CuSama ada(S)
Mengambil kira sulfat reaksi bersih adalah:
ZnSama ada(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ CuSama ada(S)
Sulfat adalah penonton, sementara logam pertukaran elektron.
Perwakilan simbolik sel galvanik
Sel galvanik Rajah 2 diwakili secara simbolik seperti berikut:
ZnSama ada(S)| Zn2+(Ac) (1m) || Cu2+(Ac) (1m) | CuSama ada(S)
Oleh konvensyen, di sebelah kiri logam yang mengoksidakan dan membentuk anod (-) dan dipisahkan oleh bar (|) ionnya dalam keadaan berair selalu diletakkan. Semi -medium anodik dipisahkan dari katodik oleh dua bar (||) yang mewakili jambatan salin. Di sebelah kanan, semi -medium logam yang dikurangkan dan membentuk katod (+) diletakkan.
Dalam perwakilan simbolik sel galvanik, akhir selalu logam yang mengoksidakan dan pada akhirnya logam diletakkan (dalam keadaan pepejal) yang dikurangkan. Harus diingat bahawa dalam Rajah 2, semikel adalah sebaliknya berkenaan dengan perwakilan simbolik konvensional.
Aplikasi
Dikenali potensi pengoksidaan standard logam yang berbeza, mungkin untuk menentukan daya elektromotif yang akan menghasilkan longgokan galvanik yang dibina dengan logam ini.
Dalam bahagian ini, perkara di atas akan dikenakan di bahagian sebelumnya untuk mengira daya elektromotor bersih sel yang dibina dengan logam lain.
Sebagai contoh permohonan, kita menganggap sel besi (iman) dan tembaga (CU) galvanik (CU). Sebagai data, tindak balas pengurangan berikut dan potensi pengurangan standardnya diberikan, iaitu, pada kepekatan 25ºC dan 1M:
Iman2+(Ac) + 2 e- → Iman(S). E1grid = -0.44 v
Cu2+(Ac) + 2 e- → Cu(S). E2grid = +0.34 v
Ia diminta untuk mencari daya elektromotor bersih yang dihasilkan oleh sel galvanik berikut:
Iman(S)| Iman2+(Ac)(1m) || cu2+(Ac)| Cu(S)
Di dalam longgokan besi mengoksidakan dan merupakan anod sel galvanik, sementara tembaga dikurangkan dan adalah katod. Potensi pengoksidaan besi adalah sama tetapi bertentangan dengan potensi pengurangannya, iaitu E1OXD = +0.44.
Untuk mendapatkan daya elektromotif yang dihasilkan oleh sel galvanik ini, kami menambah potensi pengoksidaan besi dengan potensi pengurangan tembaga:
Boleh melayani anda: nitrogen oksida (NOx)Fem = E1OXD + E2grid = -E1grid + E2grid = 0.44 V + 0.34 V = 0.78 V.
Sel galvanik dalam kehidupan seharian
Sel galvanik untuk kegunaan harian jauh dari bentuk yang digunakan sebagai model didaktik, tetapi prinsip operasi mereka adalah sama.
Sel penggunaan yang paling biasa ialah bateri alkali 1.5V dalam persembahan yang berbeza. Nama pertama datang kerana ia adalah satu set sel yang disambungkan dalam siri untuk meningkatkan FEM.
Bateri lithium yang boleh dicas semula juga berdasarkan prinsip pengoperasian sel galvanik yang sama dan yang digunakan dalam telefon pintar, jam tangan dan peranti lain.
Dengan cara yang sama, bateri utama kereta, motosikal dan bot adalah 12V dan berdasarkan prinsip pengoperasian sel galvanik yang sama.
Sel galvanik digunakan dalam estetika dan pertumbuhan semula otot. Terdapat rawatan wajah yang terdiri daripada penggunaan semasa dengan dua elektrod dalam bentuk roller atau sfera yang bersih dan menonjolkan kulit.
Denyutan semasa juga digunakan untuk menjana semula otot pada orang yang berada dalam keadaan sujud.
Pembinaan sel galvanik buatan sendiri
Terdapat banyak cara untuk membina sel galvanik buatan sendiri. Salah satu yang paling mudah adalah menggunakan cuka sebagai penyelesaian, kuku keluli dan kabel tembaga.
Bahan
-Kapal plastik sekali pakai
-Cuka putih
-Dua skru keluli
-Dua keping dawai tembaga telanjang (tanpa penebat atau varnis)
-Voltmeter
Prosedur
-Isi ¾ bahagian kaca dengan cuka.
-Sertailah dua skru keluli dengan beberapa pusingan kawat, meninggalkan sekeping wayar tanpa berliku.
Hujung kabel tembaga yang tidak berkesudahan dilipat dalam u -terbalik.
 Rajah 3. Sel galvanik buatan sendiri dan multimeter. Sumber: YouTube.com
Rajah 3. Sel galvanik buatan sendiri dan multimeter. Sumber: YouTube.com Satu lagi kabel tembaga juga dilipat ke dalam terbalik dan digantung di pinggir kaca dalam kedudukan yang bertentangan dengan skru tenggelam, sehingga satu bahagian tembaga berada di dalam cuka dan bahagian lain kabel tembaga di luar kaca.
Hujung bebas kabel voltmeter disambungkan untuk mengukur daya elektromotif yang dihasilkan oleh sel mudah ini. FEM dari jenis sel ini ialah 0.5V. Untuk memadankan FEM dari bateri alkali, perlu membina dua sel lagi dan menyertai tiga dalam siri, supaya bateri 1.5V diperolehi
Rujukan
- Borneo, r. Sel galvanik dan elektrolisis. Diperolehi dari: Kelas Quimica.Blogspot.com
- Cedrón, j. Kimia Am. Pucp. Pulih dari: Korintus.Pucp.Edu.PE
- Farrera, l. Pengenalan kepada Elektrokimia. Jabatan Fizikokimia UNAM. Pulih dari: DEPA.Fquim.Unam.mx.
- Wikipedia. Sel elektrokimia. Pulih dari: Adakah.Wikipedia.com.
- Wikipedia. Sel galvanik. Pulih dari: Adakah.Wikipedia.com.

