Struktur, CUCL) struktur, sifat, kegunaan, kegunaan
- 2424
- 36
- Donnie Ryan
Dia Tembaga klorida (i) Ia adalah sebatian bukan organik yang dibentuk oleh tembaga (Cu) dan klorin (CL). Formula kimianya adalah CUCL. Tembaga dalam sebatian ini mempunyai valencia +1 dan klorin -1. Ia adalah pepejal kristal putih yang apabila terdedah lama di udara memperoleh pewarnaan kehijauan kerana pengoksidaan tembaga (i) ke tembaga (II).
Ia berkelakuan sebagai asid Lewis yang memerlukan elektron sebatian lain yang merupakan pangkalan Lewis, yang membentuk penambahan kompleks atau stabil. Salah satu sebatian ini adalah karbon monoksida (CO), jadi keupayaan untuk bergabung di antara mereka digunakan secara industri untuk mengekstrak CO minuman ringan.
 Tembaga klorida (i) (CUCL) disucikan. Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons.
Tembaga klorida (i) (CUCL) disucikan. Leiem/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/4.0). Sumber: Wikimedia Commons. Ia mempunyai sifat optik yang boleh digunakan dalam memancarkan semikonduktor cahaya. Di samping itu, nanokub CUCL mempunyai potensi besar untuk digunakan dalam peranti tenaga yang cekap.
Ia digunakan dalam seni piroteknik kerana bersentuhan dengan api menghasilkan lampu hijau kebiruan.
[TOC]
Struktur
CUCL dibentuk oleh ion cawan cuproso+ dan anion klorida cl-. Konfigurasi elektronik CU ion+ adalah:
1s2 2s2 2 p6 3s2 3p6 3d10 4s0
Dan kerana tembaga kehilangan elektron lapisan 4S. Ion klorida mempunyai konfigurasi:
1s2 2s2 2 p6 3s2 3p6
Dapat dilihat bahawa kedua -dua ion mempunyai lapisan elektronik lengkap mereka.
Kompaun ini mengkristal dengan simetri padu. Dalam imej di bawah, susunan atom dalam unit kristal diperhatikan. Sfera merah jambu sesuai dengan sfera tembaga dan hijau ke klorin.
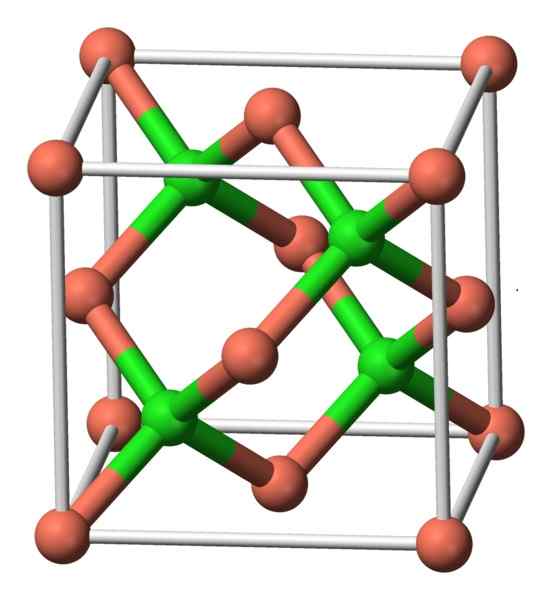 Struktur CUCL. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons.
Struktur CUCL. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons. Nomenclature
- Tembaga klorida (i)
- Cuprous Chloride
- Tembaga monocloride
Sifat
Keadaan fizikal
Pepejal putih kristal yang di udara berpanjangan dengan udara dioksidakan dan bertukar menjadi hijau.
Berat molekul
98.99 g/mol
Takat lebur
430 ºC
Takat didih
Kira -kira 1400 ºC.
Ketumpatan
4,137 g/cm3
Kelarutan
Hampir tidak larut dalam air: 0.0047 g/100 g air pada 20 ° C. Tidak larut dalam etanol (c2H5Oh) dan aseton (pilih3(C = o) ch3).
Ia boleh melayani anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohSifat kimia
Ia tidak stabil di udara kerana cu+ cenderung mengoksida CU2+. Dari masa ke masa, oksida cuprik (CUO), hidroksida cuprous (CUOH) atau oxychloride dan garam kompleks dihidupkan.
 Tembaga klorida (i) yang telah terdedah kepada persekitaran dan sebahagiannya dioksidakan. Cuoh, cuoh dan sebatian lain mungkin mengandungi. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons.
Tembaga klorida (i) yang telah terdedah kepada persekitaran dan sebahagiannya dioksidakan. Cuoh, cuoh dan sebatian lain mungkin mengandungi. Benjah-bmm27 / domain awam. Sumber: Wikimedia Commons. Dalam larutan berair, ia juga tidak stabil kerana tindak balas pengoksidaan dan pengurangan berlaku secara serentak, membentuk tembaga logam dan tembaga ion (ii):
CUCL → Cu0 + Cucl2
CUCL sebagai asid Lewis
Kompaun ini bertindak secara kimia sebagai asid Lewis, yang bermaksud bahawa ia bersemangat untuk elektron, jadi ia membentuk penambahan yang stabil dengan sebatian yang dapat memberikannya.
Ia sangat larut dalam asid hidroklorik (HCl), di mana ion cl- Mereka berkelakuan sebagai penderma elektron dan spesies seperti CUCL terbentuk2-, Cucl32- dan cu2Cl42-, antara yang lain.
 Ini adalah salah satu spesies yang terbentuk dalam penyelesaian CUCL di HCL. Pengarang: Marilú Stea.
Ini adalah salah satu spesies yang terbentuk dalam penyelesaian CUCL di HCL. Pengarang: Marilú Stea. Penyelesaian CUCL berair mempunyai keupayaan untuk menyerap karbon monoksida (CO). Penyerapan ini boleh berlaku apabila penyelesaian ini berasid dan neutral atau dengan ammonia (NH3).
Dalam penyelesaian sedemikian dianggarkan bahawa pelbagai spesies seperti Cu (CO) dibentuk+, Cuckoo)3+, Cuckoo)4+, CUCL (CO) dan [CU (CO) CL2]-, yang bergantung pada medium.
Sifat lain
Ia mempunyai ciri -ciri elektrooptik, kehilangan optik yang rendah dalam pelbagai spektrum cahaya dari yang dapat dilihat dengan indeks pembiasan rendah inframerah dan rendah dielektrik.
Memperoleh
Tembaga Klorida (I) boleh diperolehi dengan bertindak balas dengan tembaga logam secara langsung dengan gas klorin pada suhu 450-900 ° C. Reaksi ini berlaku secara industri.
2 cu + cl2 → 2 Cucl
Anda juga boleh menggunakan sebatian pengurangan seperti asid askorbik atau sulfur dioksida untuk lulus tembaga klorida (ii) ke klorida tembaga (i). Contohnya, dalam hal SO2, Ini dioksidakan dengan asid sulfurik.
2 Cucl2 + SW2 + 2 jam2O → 2 cucl + h2SW4 + 2 HCl
Aplikasi
Dalam proses penemuan bersama
Keupayaan penyelesaian penyerap dan insorber.
Boleh melayani anda: turbidimetriSebagai contoh, proses yang dipanggil Cosorb menggunakan klorida tembaga stabil dalam bentuk garam kompleks dengan aluminium (anycl4), yang larut dalam pelarut aromatik seperti toluena.
Penyelesaiannya menyerap CO arus gas untuk memisahkannya dari gas lain seperti CO2, N2 dan ch4. Maka penyelesaian yang kaya dengan monoksida dipanaskan di bawah tekanan yang dikurangkan (iaitu, lebih rendah daripada atmosfera) dan CO adalah exorg. Gas yang pulih dengan cara ini adalah kesucian yang tinggi.
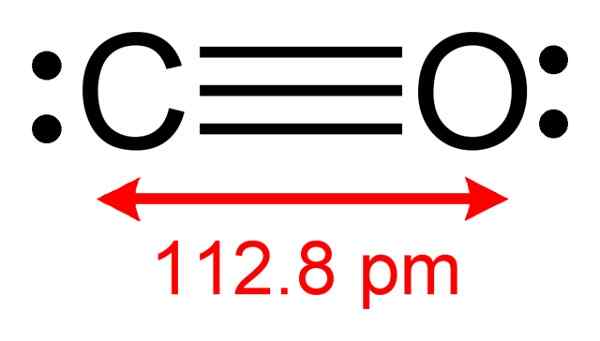 Struktur karbon monoksida di mana elektron tersedia untuk membentuk kompleks dengan CUCL diperhatikan. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons.
Struktur karbon monoksida di mana elektron tersedia untuk membentuk kompleks dengan CUCL diperhatikan. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons. Proses ini membolehkan anda mendapatkan co murni.
Pada pemangkinan
CUCL digunakan sebagai pemangkin untuk pelbagai tindak balas kimia.
Sebagai contoh, reaksi elemen Germanio (GE) dengan hidrogen klorida (HCl) dan etilena (CH2= Ch2) boleh dilakukan dengan menggunakan sebatian ini. Ia juga berfungsi untuk sintesis sebatian silikon organik dan pelbagai derivatif organik heterosiklik sulfur dan nitrogen.
Anda boleh mensintesis polimer polyphenileneter menggunakan sistem pemangkin 4-amypirin dan berjongkok. Polimer ini sangat berguna untuk sifat mekanikalnya, penyerapan kelembapan kecil, pengasingan elektrik dan rintangan kebakaran yang sangat baik.
Dalam mendapatkan sebatian tembaga organik
Sebatian alkenilcupratato boleh disediakan dengan bertindak balas dengan alky terminal.
Dalam mendapatkan polimer bersatu dengan logam
Tembaga klorida (I) boleh diselaraskan dengan polimer yang membentuk molekul kompleks yang berfungsi sebagai pemangkin dan menggabungkan kesederhanaan pemangkin heterogen dengan keteraturan homogen.
Dalam semikonduktor
Sebatian ini digunakan untuk mendapatkan bahan yang dibentuk oleh γ-corpu pada silikon.
Bahan -bahan ini mempunyai penggunaan yang luas dalam diod pemancar cahaya ultraviolet, diod laser dan pengesan cahaya.
Boleh melayani anda: kalium bromida (kbr): struktur, sifat, kegunaanDalam kadbod super
Produk ini diperolehi dalam bentuk nanopartikel padu atau nanokubes membolehkan pembuatan supercaders, kerana ia mempunyai kelajuan beban yang luar biasa, kebolehbalikan yang tinggi dan kehilangan kapasitas.
Supercorder adalah peranti untuk menyimpan tenaga yang menonjol untuk ketumpatan kuasa tinggi mereka, operasi dalam operasi, pemuatan pesat dan kitaran pelepasan, kestabilan panjang dan mesra alam.
 Nanocubos CUCL boleh digunakan dalam aplikasi elektronik dan penyimpanan tenaga. Pengarang: Tide He. Sumber: Pixabay.
Nanocubos CUCL boleh digunakan dalam aplikasi elektronik dan penyimpanan tenaga. Pengarang: Tide He. Sumber: Pixabay. Aplikasi lain
Memberi.
 Warna hijau dari beberapa bunga api mungkin disebabkan oleh pendengkurow. Pengarang: Hans Braxmeier. Sumber: Pixabay.
Warna hijau dari beberapa bunga api mungkin disebabkan oleh pendengkurow. Pengarang: Hans Braxmeier. Sumber: Pixabay. Rujukan
- Milek, j.T. dan neuberger, m. (1972). Chloride cuprous. Dalam: Bahan modular elektrooptik linear. Springer, Boston, MA. Pautan pulih.Springer.com.
- Memimpin, d.R. (Editor) (2003). Buku Panduan Kimia dan Fizik CRC. 85th CRC Press.
- Sneeden, r.P.Ke. (1982). Kaedah penyerapan/penyerapan. Dalam kimia organometallic yang komprehensif. Jilid 8. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Kemajuan terkini dalam sintesis langsung sebatian organometal dan koordinasi. Sintesis langsung kompleks logam. Pulih dari Scientedirect.com.
- Kyushin, s. (2016). Sintesis Organosilicon untuk Pembinaan Kelompok Organosilicon. Dalam kaedah yang cekap untuk penyediaan sebatian silikon. Pulih dari Scientedirect.com.
- Van Koten, G. dan noltes, j.G. (1982). Sebatian Organocopper. Dalam kimia organometallic yang komprehensif. Jilid 2. Pulih dari Scientedirect.com.
- Danieluk, d. et al. (2009). Ciri -ciri optik filem CUCL doped dan oksigen pada sublate silikon. J Mater Sci: Mater Electron (2009) 20: 76-80. Pautan pulih.Springer.com.
- Yin, b. et al. (2014). Nanokube klorida cuprous yang ditanam pada tembaga gagal untuk elektrod pseudocapacitor. Nano-Micro Lett. 6, 340-346 (2014). Pautan pulih.Springer.com.
- Kim, k. et al. (2018). Ligan amina/tembaga amina yang sangat cekap (i) klorid. Polimer 2018, 10, 350. MDPI pulih.com.
- Wikipedia (2020). Tembaga (i) klorida. Diambil dari.Wikipedia.org.
- « Pecahan molar bagaimana ia dikira, contoh, latihan
- Butyric Fat Mendapatkan, Jenis, Komposisi, Kegunaan, Manfaat »

