Diphenylamine
- 1280
- 325
- Ms. Edgar Carroll
Apa itu defilamine?
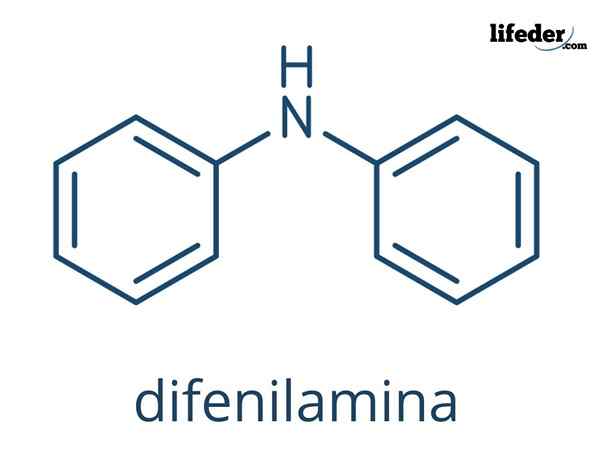
The Diphenylamine Ia adalah sebatian organik yang formula kimianya (c6H5)2NH. Namanya menunjukkan bahawa ia adalah amina, serta formulanya (-nh2). Sebaliknya, istilah "diffenil" merujuk kepada kehadiran dua cincin aromatik yang dikaitkan dengan nitrogen. Oleh itu, defilamine adalah amina aromatik.
Di dalam dunia sebatian organik, perkataan aromatik tidak semestinya berkaitan dengan kewujudan bau, tetapi kepada ciri -ciri yang menentukan tingkah laku kimia mereka terhadap spesies tertentu.

Dalam kes diphenylamine, aromatiknya dan fakta bahawa pepejal mereka hadir aroma tersendiri bertepatan. Walau bagaimanapun, asas atau mekanisme yang mengawal tindak balas kimianya dapat dijelaskan oleh watak aromatiknya, tetapi bukan kerana aroma yang menyenangkannya.
Struktur kimianya, asas, aromatik dan interaksi intermolecular adalah pembolehubah yang bertanggungjawab untuk sifatnya: dari warna kristalnya kepada kebolehgunaannya sebagai ejen antioksidan.
Struktur kimia defilamin

Dalam imej unggul, struktur kimia diffenilamine diwakili. Sfera hitam sesuai dengan atom karbon, putih ke atom hidrogen dan biru ke atom nitrogen.
Perbezaan antara kedua -dua imej adalah model bagaimana mereka mewakili molekul secara grafik. Di bawah ia menyoroti aromatik cincin dengan garis -garis yang dihiasi hitam dan, juga, geometri rata cincin ini dibuktikan.
Kedua -dua imej itu tidak menunjukkan pasangan elektron bersendirian yang tidak dikongsi pada atom nitrogen. Elektron ini "berjalan" melalui sistem π konjugasi ikatan berganda dalam cincin. Sistem ini membentuk sejenis awan beredar yang membolehkan interaksi intermolecular; iaitu, dengan cincin lain dari molekul lain.
Ia boleh melayani anda: Termometer Makmal: Ciri -ciri, Apa itu, Gunakan, ContohnyaDi atas bermaksud bahawa tork nitrogen yang tidak dikongsi berjalan melalui kedua -dua cincin, mengedarkan ketumpatan elektronik ini, dan kemudian mereka kembali ke nitrogen, untuk mengulangi kitaran lagi.
Dalam proses ini, ketersediaan elektron ini berkurangan, mengakibatkan penurunan asas dipelamine (kecenderungannya untuk mendermakan elektron sebagai pangkalan Lewis).
Penggunaan/aplikasi dipenylamine
Diphenylamine adalah ejen pengoksidaan yang mampu memenuhi satu siri fungsi, dan di antaranya adalah yang berikut:
- Semasa penyimpanan mereka, epal dan pear mengalami proses fisiologi yang dipanggil scalding, berkaitan dengan pengeluaran trieno konjugasi, yang membawa kepada kerosakan kulit buah -buahan. Tindakan dipenylamine membolehkan meningkatkan tempoh penyimpanan, mengurangkan buah -buahan merosakkan 10 % daripada apa yang diperhatikan semasa ketiadaan mereka.
- Semasa memerangi pengoksidaan, diphenylamine dan derivatifnya memanjangkan fungsi enjin dengan mengelakkan penebalan minyak terpakai.
- Diphenylamine digunakan untuk mengehadkan tindakan ozon dalam pembuatan getah.
- Diphenylamine digunakan dalam kimia analisis untuk pengesanan nitrat (tidak3-), Klorat (CLO3-) dan agen pengoksidaan lain.
- Ia adalah penunjuk yang digunakan dalam ujian pengesanan keracunan nitrat.
- Apabila RNA dihidrolisis selama satu jam, ia bertindak balas dengan defilamine; Ini membolehkan kuantiti.
- Dalam Perubatan Veterinar, Dipe -pilamine digunakan secara topikal dalam pencegahan dan rawatan manifestasi cacing boreride dalam haiwan pembiakan.
- Beberapa derivatif duelamine tergolong dalam kategori ubat anti-radang bukan steroid. Mereka juga boleh mempunyai kesan farmakologi dan terapeutik seperti antimikrob, analgesik, anticonvulsants dan aktiviti anti -kanser.
Penyediaan dipenylamine
Secara semulajadi, defilamine dihasilkan dalam bawang, di cilantros, di daun teh hijau dan hitam, dan di cengkerang buah sitrus. Secara sintetik, terdapat banyak laluan yang membawa kepada sebatian ini, seperti:
Deaminasi haba aniline
Ia disediakan oleh deaminasi haba aniline (c6H5NH2) Dengan kehadiran pemangkin pengoksidaan.
Sekiranya aniline dalam tindak balas ini tidak menggabungkan atom oksigen ke strukturnya, mengapa anda mengoksida? Kerana cincin aromatik adalah kumpulan penarik elektron, tidak seperti atom H, yang menyumbangkan ketumpatan nitrogen elektronik yang rendah dalam molekul.
2 c6H5NH2 => (C5H5)2 NH+NH3
Juga, aniline boleh bertindak balas dengan garam aniline hydrochloride (c6H5NH3+Cl-) di bawah pemanasan 230 ºC selama dua puluh jam.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Reaksi Phenotizine
Dipenylamine berasal dari beberapa yang diperolehi apabila digabungkan dengan reagen yang berbeza. Salah satu daripadanya adalah phenotizine, yang, mensintesis dengan sulfur adalah pendahulu derivatif dengan tindakan farmaseutikal.
(C6H5)2NH +2S => S (C6H4) NH +H2S

Sifat dipenylamine
Denylamine adalah pepejal kristal putih yang, bergantung kepada kekotorannya, dapat memperoleh nada bronknea, ambar atau kuning. Ia mempunyai aroma bunga yang menyenangkan, ia mempunyai berat molekul 169.23 g/mol dan ketumpatan 1.2 g/ml.
Molekul pepejal ini berinteraksi oleh daya van der Waals, di antaranya adalah jambatan hidrogen yang dibentuk oleh atom nitrogen (NH-NH) dan penumpukan cincin aromatik, berehat "awan elektronik" mereka.
Boleh melayani anda: Zink Sulfide (ZnS)Sebagai cincin aromatik banyak menduduki. Di atas menyebabkan pepejal tidak mempunyai titik gabungan yang sangat tinggi (53 ºC).
Walau bagaimanapun, dalam keadaan cecair, molekul lebih berasingan dan keberkesanan jambatan hidrogen bertambah baik. Begitu juga, defilamine agak berat, memerlukan banyak haba untuk bergerak ke fasa gas (302 ºC, titik mendidihnya). Ini juga disebabkan sebahagiannya berat dan interaksi cincin aromatik.
Kelarutan dan asas
Ia sangat tidak larut dalam air (0.03 g/100 g air) kerana sifat hidrofobik cincin aromatiknya. Sebaliknya, ia sangat larut dalam pelarut organik seperti benzena, karbon tetraklorida (CCL4), aseton, etanol, piridin, asid asetik, dll.
Pemalar keasidannya (PKA) adalah 0.79, yang merujuk kepada keasidan asid konjugasi (c6H5NH3+). Proton yang ditambahkan ke nitrogen mempunyai kecenderungan untuk sebahagian, kerana sepasang elektron yang dihubungkan dapat berjalan melalui cincin aromatik. Oleh itu, ketidakstabilan tinggi c6H5NH3+ Ia mencerminkan asas rendah diffenilamine.
Rujukan
- Perbadanan Lubrizol. (2018). Antioksidan Diphenylamine. Pulih dari Lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Aplikasi farmakologi diphenylamine dan derivatifnya sebagai sebatian bioaktif yang kuat: ulasan. Sebatian Bioaktif Semasa, Jilid 13.
- Prepchem. (2015-2016). Penyediaan diphenylamine. Pulih dari prepchem.com
- Pubchem. (2018). Diphenylamine. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Wikipedia. (2018). Diphenylamine. Diambil dari.Wikipedia.org

