Struktur lewis apa yang terdiri daripada, bagaimana ia dilakukan, contohnya

- 2556
- 714
- Julius Dibbert
The Struktur Lewis Ini semua perwakilan ikatan kovalen dalam molekul atau ion. Di dalamnya, bon dan elektron ini diwakili dengan titik panjang atau skrip, walaupun kebanyakan masa titik sesuai dengan elektron yang tidak dikongsi dan skrip kepada ikatan kovalen.
Tetapi apakah pautan kovalen? Ia adalah perkongsian beberapa elektron (atau mata) antara dua atom jadual berkala. Dengan gambar rajah ini, anda boleh melukis banyak kerangka untuk sebatian tertentu. Yang mana antara mereka adalah yang betul bergantung pada beban formal dan sifat kimia atom yang sama.
 Kompaun 2-Bromopropan. Oleh Ben juta [domain awam], dari Wikimedia Commons.
Kompaun 2-Bromopropan. Oleh Ben juta [domain awam], dari Wikimedia Commons. Dalam imej yang unggul terdapat contoh struktur Lewis. Dalam kes ini, kompaun yang diwakili ialah 2-bromopropano. Titik hitam yang sepadan dengan elektron dapat dilihat, kedua -dua mereka yang mengambil bahagian dalam pautan dan mereka yang tidak dikongsi (satu -satunya tork di atas BR).
Jika titik titik ":" digantikan dengan skrip panjang "-", maka rangka karbon 2-bromopropano akan diwakili sebagai: c-c-c. Kenapa bukannya "bingkai molekul" yang ditarik, bolehkah C-H-C? Jawapannya terletak pada ciri -ciri elektronik setiap atom.
Oleh itu, kerana hidrogen hanya mempunyai satu elektron dan satu orbital yang tersedia untuk diisi, hanya ikatan kovalen. Oleh itu, anda tidak boleh membentuk dua bon (tidak mengelirukan dengan jambatan hidrogen). Sebaliknya, konfigurasi elektronik atom karbon membolehkan (dan menuntut) pembentukan empat ikatan kovalen.
Atas sebab itu, struktur Lewis di mana C dan H mesti konsisten dan menghormati apa yang ditadbir oleh konfigurasi elektronik mereka. Dengan cara ini, jika karbon mempunyai lebih daripada empat bon, atau hidrogen lebih dari satu, maka lakaran itu dapat diketepikan dan memulakan yang baru sejajar dengan realiti.
Di sinilah beberapa sebab utama atau belakang struktur ini muncul, diperkenalkan oleh Gilbert Newton Lewis dalam pencarian mereka untuk perwakilan molekul setia kepada data eksperimen: struktur molekul dan beban formal.
Semua sebatian sedia ada boleh diwakili oleh struktur Lewis, memberikan pendekatan pertama tentang bagaimana molekul atau ion boleh.
[TOC]
Apakah struktur Lewis?
Ia adalah struktur wakil elektron valencia dan ikatan kovalen dalam molekul atau ion yang berfungsi untuk mempunyai idea struktur molekulnya.
Walau bagaimanapun, struktur ini gagal meramalkan beberapa butiran penting seperti geometri molekul berkenaan dengan atom dan persekitarannya (jika ia adalah persegi, rata, bipiramidal, dll.).
Ia juga tidak mengatakan apa -apa mengenai apa hibridisasi kimia atomnya, tetapi di mana ikatan beregu atau tiga diletakkan dan jika terdapat resonans dalam struktur.
Dengan maklumat ini, anda boleh berhujah tentang kereaktifan sebatian, kestabilannya, bagaimana dan mekanisme apa yang akan diikuti oleh molekul ketika bertindak balas.
Atas sebab ini struktur Lewis tidak pernah berhenti dipertimbangkan dan sangat berguna, kerana mereka dapat memendekkan pembelajaran kimia baru.
Bagaimana ia dilakukan?
Untuk melukis atau melukis struktur, formula atau gambarajah Lewis, formula kimia sebatian itu penting. Tanpa itu, anda tidak dapat mengetahui apa atom yang membuatnya. Sekali dengannya, jadual berkala digunakan untuk mencari kumpulan mana yang dimiliki.
Boleh melayani anda: kelikatan: contoh, sebab, unit, jenisContohnya, jika anda mempunyai kompaun c14Sama ada2N3 Kemudian kita perlu mencari kumpulan di mana karbon, oksigen dan nitrogen adalah. Selesai ini, tanpa mengira sebatian, bilangan elektron valensi tetap sama, begitu lambat laun mereka menghafal.
Oleh itu, karbon milik kumpulan VAT, oksigen ke kumpulan VIA dan nitrogen ke VA. Nombor kumpulan adalah sama dengan jumlah elektron (mata) Valencia. Kesemuanya mempunyai persamaan kecenderungan untuk menyelesaikan oktet lapisan Valencia.
Apakah peraturan oktet?
Ini mengatakan terdapat trend atom untuk menyelesaikan tahap tenaga dengan lapan elektron untuk mencapai kestabilan. Ini terpakai kepada semua elemen bukan logam atau yang terdapat di blok s atau p dari jadual berkala.
Walau bagaimanapun, tidak semua elemen mematuhi peraturan oktet. Kes -kes tertentu adalah logam peralihan, strukturnya lebih berdasarkan beban formal dan nombor kumpulan mereka.
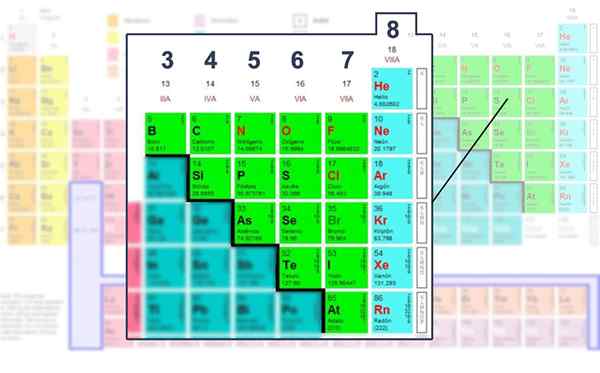 Bilangan elektron lapisan Valencia unsur -unsur bukan logam, yang mana ia dapat dikendalikan dengan struktur Lewis.
Bilangan elektron lapisan Valencia unsur -unsur bukan logam, yang mana ia dapat dikendalikan dengan struktur Lewis. Memohon formula matematik
Mengetahui kumpulan mana yang dimiliki oleh unsur -unsur, dan oleh itu, bilangan elektron valensi yang tersedia untuk membentuk pautan, formula berikut dibuat, yang berguna untuk menarik struktur Lewis:
C = n - d
Di mana c bermaksud elektron bersama, iaitu, mereka yang mengambil bahagian dalam ikatan kovalen. Oleh kerana setiap pautan terdiri daripada dua elektron, maka c/2 adalah sama dengan bilangan pautan (atau skrip) yang mesti ditarik.
N adalah elektron yang diperlukan, Mereka yang mesti mempunyai atom di lapisan Valencia untuk menjadi isolektronik kepada gas mulia yang mengikuti dalam tempoh yang sama. Untuk semua elemen selain H (kerana ia memerlukan dua elektron untuk membandingkannya dengan HE) mereka memerlukan lapan elektron.
D adalah elektron yang ada, yang ditentukan oleh bilangan kumpulan atau elektron valencia. Oleh itu, sebagai CL milik Kumpulan VIIA, ia mesti dikelilingi oleh tujuh hitam atau elektron, dan perlu diingat bahawa pasangan diperlukan untuk membentuk pautan.
Mempunyai atom, titik mereka dan bilangan pautan c/2, struktur Lewis kemudian dapat diperbaiki. Tetapi selain itu, adalah perlu mempunyai tanggapan mengenai "peraturan" yang lain.
Di mana untuk meletakkan atom elektronegatif yang kurang
Atom elektronegatif yang kurang dalam sebahagian besar struktur menduduki pusat. Atas sebab ini, jika anda mempunyai sebatian dengan atom p, o dan f, p oleh itu mesti berada di tengah -tengah struktur hipotesis.
Ia juga penting untuk menyerlahkan bahawa hidrogen biasanya dikaitkan dengan atom elektronegatif. Sekiranya anda mempunyai Zn, H dan O kompaun, H akan pergi bersebelahan dengan O dan bukan dengan Zn (Zn-O-H dan No H-Zn-O). Terdapat pengecualian untuk peraturan ini, tetapi biasanya berlaku dengan atom bukan logam.
Simetri dan beban rasmi
Alam mempunyai keutamaan yang tinggi untuk menyebabkan struktur molekul sebagai simetri yang mungkin. Ini membantu mengelakkan meningkatkan struktur tidak senonoh, dengan atom yang disusun sedemikian rupa sehingga mereka tidak mematuhi corak yang jelas.
Ia boleh melayani anda: Teori-Bass Teori: Arrhenius, Bronsted-Lowry, LewisContohnya, untuk kompaun c2Ke3, Di mana a adalah atom fiksyen, struktur yang paling mungkin ialah a-c-a-c-a. Perhatikan simetri sisi mereka, kedua -dua refleksi yang lain.
Beban rasmi juga memainkan peranan penting ketika melukis struktur Lewis, terutama untuk ion. Oleh itu, pautan boleh ditambah atau dikeluarkan supaya beban rasmi atom sepadan dengan jumlah beban yang dipaparkan. Kriteria ini sangat membantu bagi sebatian logam peralihan.
Batasan dalam peraturan oktet
 Perwakilan aluminium trifluoride, sebatian yang tidak stabil. Kedua -dua elemen terdiri daripada enam elektron, yang menghasilkan tiga ikatan kovalen, ketika mereka harus lapan untuk mencapai kestabilan. Sumber: Gabriel Bolívar
Perwakilan aluminium trifluoride, sebatian yang tidak stabil. Kedua -dua elemen terdiri daripada enam elektron, yang menghasilkan tiga ikatan kovalen, ketika mereka harus lapan untuk mencapai kestabilan. Sumber: Gabriel Bolívar Tidak semua peraturan dipenuhi, yang tidak semestinya bermaksud bahawa struktur itu tidak betul. Contoh tipikal ini diperhatikan dalam banyak sebatian di mana unsur -unsur kumpulan IIIa (b, al, ga, dalam, TL) terlibat. Di sini secara khusus dianggap aluminium trifluoruro (ALF3).
Kemudian memohon formula yang diterangkan di atas, anda mempunyai:
D = 1 × 3 (atom aluminium) + 7 × 3 (tiga atom fluorin) = 24 elektron
Di sini pada 3 dan 7 adalah kumpulan atau bilangan elektron valensi yang tersedia untuk aluminium dan fluorida. Kemudian, memandangkan elektron yang diperlukan n:
N = 8 × 1 (atom aluminium) + 8 × 3 (tiga atom fluorin) = 32 elektron
Dan oleh itu elektron bersama adalah:
C = n - d
C = 32 - 24 = 8 elektron
C/2 = 4 pautan
Oleh kerana aluminium adalah atom elektronegatif paling sedikit, ia mesti diletakkan di tengah, dan fluorin hanya membentuk pautan. Memandangkan ini anda mempunyai struktur Lewis del Alf3 (gambar atas). Elektron yang dikongsi diketengahkan dengan titik hijau untuk membezakannya dari yang tidak terkawal.
Walaupun pengiraan meramalkan bahawa terdapat 4 pautan yang mesti dibentuk, aluminium tidak mempunyai elektron yang mencukupi dan tidak ada atom fluorin keempat. Akibatnya, aluminium tidak mematuhi peraturan oktet dan fakta ini tidak dapat dilihat dalam pengiraan.
Contoh struktur Lewis
Iodin
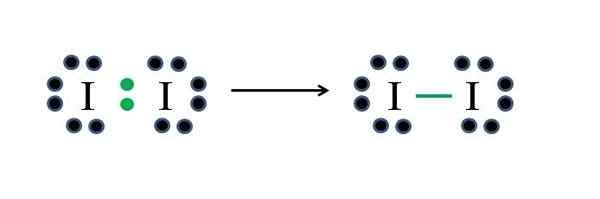 IODO Non -metals mempunyai tujuh elektron masing -masing, jadi dengan berkongsi salah satu daripada elektron masing -masing, mereka menghasilkan ikatan kovalen yang memberi mereka kestabilan. Sumber: Gabriel Bolívar
IODO Non -metals mempunyai tujuh elektron masing -masing, jadi dengan berkongsi salah satu daripada elektron masing -masing, mereka menghasilkan ikatan kovalen yang memberi mereka kestabilan. Sumber: Gabriel Bolívar Iodin adalah halogen dan oleh itu milik kumpulan VIIA. Ia kemudiannya mempunyai tujuh elektron Valencia, dan molekul diatomik mudah ini dapat diwakili improvisasi atau memohon formula:
D = 2 × 7 (dua atom iodin) = 14 elektron
N = 2 × 8 = 16 elektron
C = 16 - 14 = 2 elektron
C/2 = 1 pautan
Sebagai 14 elektron 2 mengambil bahagian dalam ikatan kovalen (titik hijau dan skrip), 12 kekal sebagai tidak dikongsi; Dan kerana mereka adalah dua atom iodin, 6 mesti diedarkan untuk salah satu daripada mereka (elektron valensi mereka). Dalam molekul ini hanya struktur ini mungkin, yang geometrinya linear.
Ammonia
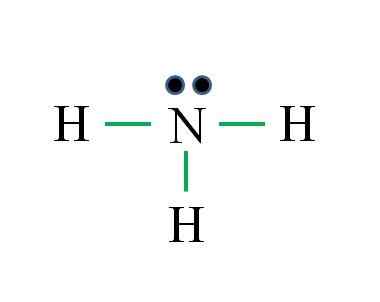 Nitrogen mempunyai 5 elektron, sementara hidrogen hanya 1. Cukup untuk mencapai kestabilan apabila tiga ikatan kovalen ditubuhkan, terdiri daripada elektron N dan satu lagi sumber H: Gabriel Bolívar
Nitrogen mempunyai 5 elektron, sementara hidrogen hanya 1. Cukup untuk mencapai kestabilan apabila tiga ikatan kovalen ditubuhkan, terdiri daripada elektron N dan satu lagi sumber H: Gabriel Bolívar Apakah struktur Lewis untuk molekul ammonia? Sebagai nitrogen berasal dari kumpulan VA, ia mempunyai lima elektron Valencia, dan kemudian:
Ia boleh melayani anda: Termometer Makmal: Ciri -ciri, Apa itu, Gunakan, ContohnyaD = 1 × 5 (atom nitrogen) + 1 × 3 (tiga atom hidrogen) = 8 elektron
N = 8 × 1 + 2 × 3 = 14 elektron
C = 14 - 8 = 6 elektron
C/2 = 3 pautan
Kali ini formula adalah betul dengan bilangan pautan (tiga pautan hijau). Sehingga 8 elektron yang tersedia 6 mengambil bahagian dalam bon, terdapat tork yang tidak dikongsi yang terletak di atas atom nitrogen.
Struktur ini mengatakan segala yang harus diketahui dari pangkalan ammonia. Menggunakan pengetahuan tentang TEV dan TRPEV, ia mengikuti bahawa geometri adalah tetrahedral yang diputarbelitkan oleh tork nitrogen percuma dan bahawa hibridisasi ini adalah SP3.
C2H6Sama ada
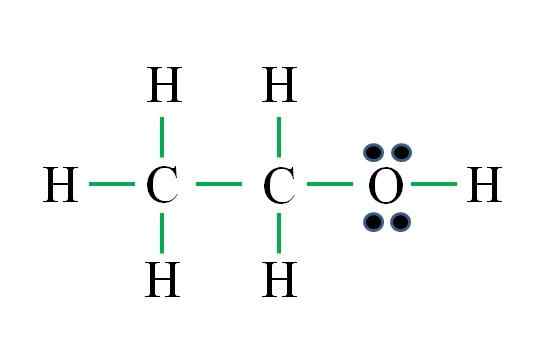 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Formula sepadan dengan sebatian organik. Sebelum menggunakan formula, harus diingat bahawa hidrogen membentuk satu ikatan, oksigen dua, karbon empat dan strukturnya mestilah sebagai simetri yang mungkin. Meneruskan sebagai contoh sebelumnya adalah:
D = 6 × 1 (enam atom hidrogen) + 6 × 1 (atom oksigen) + 4 × 2 (dua atom karbon) = 20 elektron
N = 6 × 2 (enam atom hidrogen) + 8 × 1 (atom oksigen) + 8 × 2 (dua atom karbon) = 36 elektron
C = 36 - 20 = 16 elektron
C/2 = 8 pautan
Bilangan skrip hijau sesuai dengan 8 pautan yang dikira. Struktur Lewis yang dicadangkan ialah etanol ch3Ch2Oh. Walau bagaimanapun, ia juga betul untuk mencadangkan struktur dimetil eter3Och3, yang lebih simetri.
Yang mana kedua -duanya adalah "lebih" betul? Kedua -duanya sama, kerana struktur timbul sebagai isomer struktur formula molekul yang sama c2H6Sama ada.
Ion permanganat
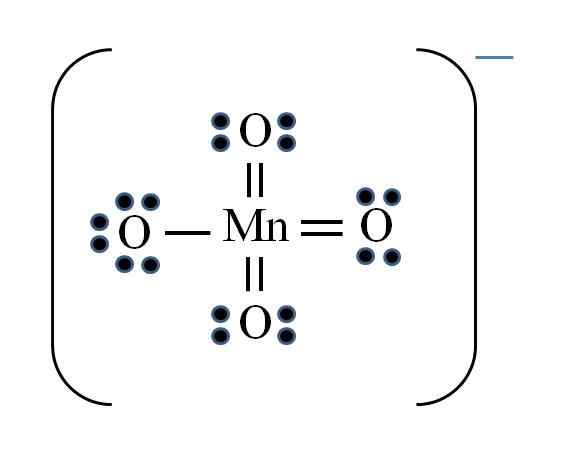 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Keadaan ini rumit apabila anda ingin melakukan struktur Lewis untuk sebatian logam peralihan. Mangan milik kumpulan viib, juga, elektron beban negatif mesti ditambah di antara elektron yang ada. Memohon formula yang anda ada:
D = 7 × 1 (atom mangan) + 6 × 4 (empat atom oksigen) + 1 elektron per beban = 32 elektron
N = 8 × 1 + 8 × 4 = 40 elektron
C = 40 - 32 = 8 elektron bersama
C/2 = 4 pautan
Walau bagaimanapun, logam peralihan boleh mempunyai lebih daripada lapan elektron di Valencia. Juga, untuk ion mno4- Mempamerkan beban negatif, adalah perlu untuk mengurangkan beban rasmi atom oksigen. Sebagai? Melalui pautan berganda.
Sekiranya semua pautan MNO4- Mereka mudah, beban rasmi oksigen akan sama dengan -1. Oleh kerana terdapat empat, beban yang dihasilkan akan -4 untuk anion, yang jelas tidak benar. Apabila ikatan berganda terbentuk, dijamin bahawa oksigen tunggal mempunyai beban formal negatif, yang dicerminkan dalam ion.
Di ion permanganat dapat dilihat bahawa ada resonans. Ini menunjukkan bahawa satu-satunya pautan Mn-O yang mudah dihapuskan antara empat atom o.
Dicromato ion
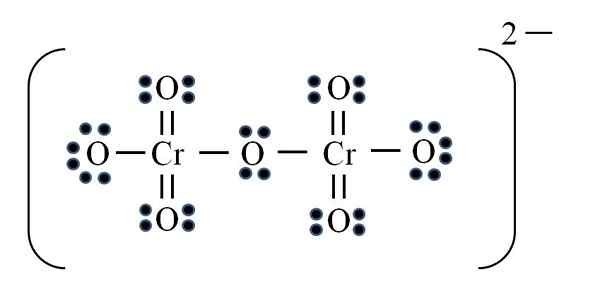 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Akhirnya, kes yang sama berlaku dengan ion dicroMato (CR2Sama ada7). Krom milik kumpulan VIB, jadi ia mempunyai enam elektron Valencia. Memohon formula lagi:
D = 6 × 2 (dua atom krom) + 6 × 7 (tujuh atom oksigen) + 2 elektron dengan beban divalen = 56 elektron
N = 8 × 2 + 8 × 7 = 72 elektron
C = 72 - 56 = 16 elektron bersama
C/2 = 8 pautan
Tetapi tidak ada 8 pautan, tetapi 12. Atas sebab yang sama, dalam ion permanganat dua oksigen mesti ditinggalkan dengan beban formal negatif yang menambah sama dengan -2, beban ion dicroMato.
Oleh itu, kerana banyak pautan berganda ditambah seperti yang diperlukan. Dengan cara ini anda mencapai struktur Lewis imej untuk CR2Sama ada72-.
Rujukan
- Whitten, Davis, Peck & Stanley. Kimia. (8th ed.). Pembelajaran Cengage, ms 251.
- Struktur Lewis. Diambil dari: chemed.Chem.Purdue.Edu
- Steven a. Hardinger, Jabatan Kimia & Biokimia, UCLA. (2017). Struktur Lewis. Diambil dari: chem.UCLA.Edu
- Wayne Breslyn. (2012). Lukisan struktur Lewis. Diambil dari: TerpConnect.Umd.Edu
- Webmaster. (2012). Struktur lewis ("dot elektron"). Jabatan Kimia, Universiti Maine, Orono. Diambil dari: Kimia.Umeche.Maine.Edu
- Lancaster, Sean. (25 April 2017). Cara Menentukan Berapa Banyak Titik Di Pada Struktur Lewis Dot Elemen. Saintifik. Pulih dari: saintifik.com

