Hydronio ion
- 2735
- 586
- Kerry Schmitt
Apakah ion hidronium?
Dia Hydronio ion Ia adalah sejenis beban positif yang dihasilkan dari protonasi molekul air, dan formula kiminya adalah h3Sama ada+. Ia terdiri daripada yang paling mudah dari Oxonians: ion di mana oksigen membawa beban formal positif dan mempunyai tiga ikatan kovalen.
H3Sama ada+ Ia adalah salah satu kation yang paling mudah tetapi ingin tahu yang wujud. Dalam air di bawah keadaan normal ia mempunyai kepekatan 1 · 10-7 M, produk keseimbangan diri. Walau bagaimanapun, kepekatannya meningkat secara eksponen apabila kuat3Sama ada+ Mereka membubarkan air, mengidapinya.
 Molekul ion hidronium
Molekul ion hidronium Kepekatan atau aktiviti h3Sama ada+ Di dalam air ia berfungsi untuk mengukur keasidan penyelesaian berair: pH. Lebih banyak ion3Sama ada+ Hay, kurang positif akan pH, dan lebih banyak asid akan menjadi penyelesaian yang dipersoalkan. Keasidan ini, sebaliknya, terletak pada ion hidrogen, h+, yang sering dikelirukan dengan ion h3Sama ada+.
 Formula kation ion atau hidronio
Formula kation ion atau hidronio H+ Dan keupayaannya yang luar biasa untuk memindahkan antara jambatan hidrogen molekul air membolehkan H3Sama ada+ bersekutu dalam pembentukan kation yang lebih kompleks; seperti kation Eigen, h9Sama ada4+, dan kation Zundel, h5Sama ada2+, dan banyak lagi.
Struktur ion hidronium
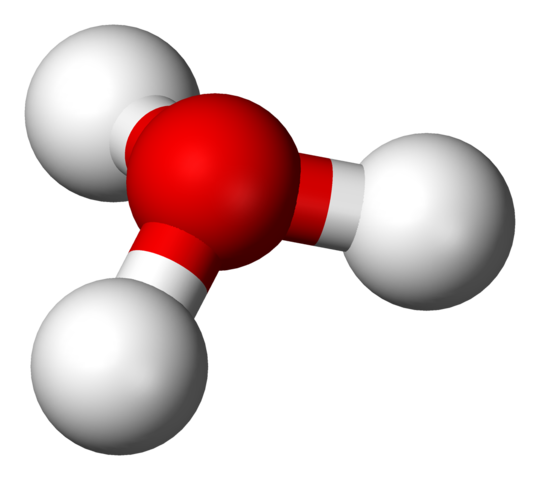 Struktur H3O+ dengan model sfera dan bar
Struktur H3O+ dengan model sfera dan bar Dalam imej pertama anda dapat melihat formula struktur ion hidrium. Sekarang kita melihat perwakilannya dengan model sfera dan bar. Dalam kedua-dua sorotan geometri piramid trigonal, yang menghubungkan sudut (O-H) ialah 113º; Sedikit dialihkan dari 119º untuk tetrahedron.
Walaupun oksigen mempunyai beban separa positif, ini tidak bermakna bahawa rantau negatif adalah sekitar atom hidrogen. Sebaliknya. Oksigen dalam h3Sama ada+ Ia lebih banyak produk elektronegatif kekurangan elektroniknya; Oleh itu, semua ketumpatan negatif digambarkan pada peta potensi elektrostatik:
Boleh melayani anda: kalium sulfat (K2SO4): Struktur, sifat, kegunaan, sintesis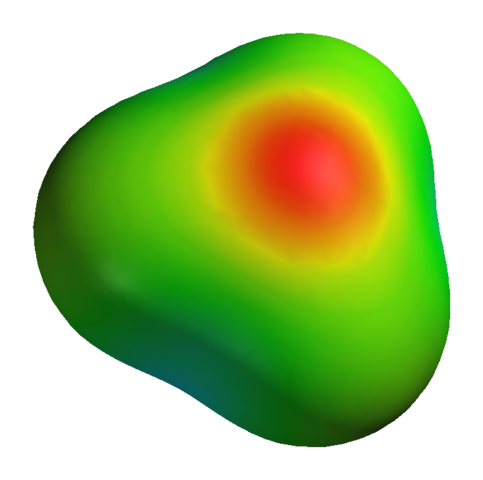 Peta potensi elektrostatik untuk H3O+
Peta potensi elektrostatik untuk H3O+ Belum lagi bahawa oksigen mempunyai beberapa elektron bebas, yang memperkuat ketumpatan negatif.
Akibat dari semua perkara di atas adalah bahawa H hidrogen3Sama ada+ Mereka kehilangan ketumpatan elektronik, kerana oksigen menariknya ke arah dirinya. Oleh itu, h3Sama ada+ Anda boleh menubuhkan sumber hidrogen yang sangat kuat dengan molekul air jiran: h2Sama ada+-H-oh2.
Interaksi ini adalah kunci di sebalik mobiliti ionik yang menakjubkan h+ dan mengapa h3Sama ada+ Ia dapat mengaitkan dengan banyak molekul air pada masa yang sama.
Keasidan
Ion hidronio adalah asid yang sangat kuat. Malah, ia adalah asid terkuat yang boleh wujud dalam larutan akueus. Kerana? Kerana mana -mana asid lain yang lebih kuat daripada dia akan menonjolkan molekul air yang berasal dari h3Sama ada+:
Ha + h2O → a- + H3Sama ada+
H3Sama ada+ Ia dapat kekal stabil apabila tidak ada pangkalan lain di persekitaran yang lebih kuat daripada air. Sebarang asid telah mematuhi ini akan diklasifikasikan sebagai asid yang kuat. Sementara itu, jika asid lebih lemah daripada h3Sama ada+, Kemudian sebahagian daripada HA tidak akan dipisahkan sepenuhnya dan kita akan bercakap tentang asid yang lemah:
Ha + h2Atau ⇌ a- + H3Sama ada+
Oleh itu, kerana h3Sama ada+ Ia adalah asid terkuat yang ada di dalam air, keasidan ini bergantung kepada kepekatan h3Sama ada+. Ini adalah asas untuk menentukan, secara ringkas, keasidan larutan berair yang dinyatakan sebagai pH:
ph = -log [h3Sama ada+]
H+ Vs. H3Sama ada+
Ion hidrogen dan hidronium tidak sama. H+ Jauh lebih berasid daripada h3Sama ada+, Nah, ia terdiri daripada proton tidak lebih, yang akan mencari molekul untuk mendapatkan elektron dengan segala cara. Bila h+ Dapatkan Borang Molekul Air H3Sama ada+:
Ia boleh melayani anda: Cupric Oxide (CUO)H+ + H2O → h3Sama ada+
Itulah sebabnya h3Sama ada+ boleh diwakili sebagai h+(Ac), menunjukkan bahawa ia adalah h+ Dalam medium berair.
Kekuatan asid diukur dalam keupayaannya untuk menderma, menurut definisi brönsted-lowry, h ion+. Betapa lebih kuatnya, semakin banyak ia akan menderma+, Tidak h3Sama ada+. Asid terkuat yang pernah disintesis (supercids) adalah di mana h+ Dia "telanjang"; iaitu, tanpa sebarang halangan untuk melompat ke arah molekul yang akan menonjol.
Amalan mewakili h3Sama ada+ sebagai h+(Ac) Sangat biasa bahawa terdapat banyak kali bercakap tentang kedua -duanya seolah -olah mereka sama, tanpa memberi kesan negatif terhadap tafsiran kimia penyelesaian.
Solvation
H3Sama ada+ Ia boleh membentuk jambatan hidrogen yang sangat kuat dengan molekul air jiran. Dengan berbuat demikian, kami mempunyai kation Zundel, H5Sama ada2+:
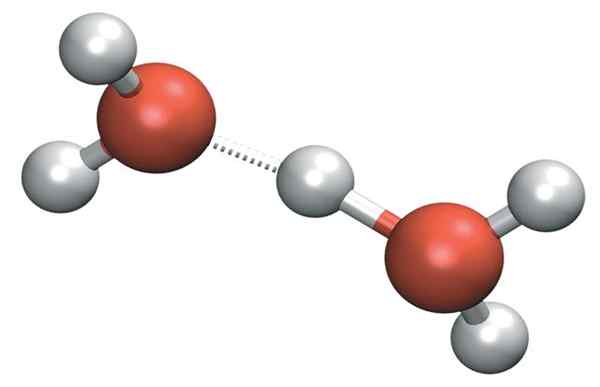 Zundel Cation
Zundel Cation Tetapi beban positif tidak hanya kekal pada satu sisi kation: ini boleh dipindahkan ke molekul air lain seperti ion h+:
H2O- h-+Oh2 → h2Sama ada+-H- oh2
Oleh itu, beban positif diedarkan antara kedua -dua atom oksigen untuk kedua -dua molekul air.
Dalam kes kation eigen, h9Sama ada4+, h3Sama ada+ Bentuk jambatan hidrogen dengan tiga molekul air, mengedarkan di antara mereka beban positif terima kasih kepada "lompat" h+. Lompatan ini begitu pantas, sehingga mereka menerangkan mobiliti ionik yang hebat dari H+ Di dalam air, menggunakan h3Sama ada+ sebagai kenderaan, dan molekul air seperti lebuh raya.
H5Sama ada2+ dan h9Sama ada4+ Mereka bukan satu -satunya persatuan kationik yang h3Sama ada+ boleh berasal dari air. Beberapa pengiraan dinamik molekul menunjukkan kewujudan kluster H3Sama ada+(H2Sama ada)dua puluh: 20 jam molekul2Atau berinteraksi dengan kation3Sama ada+ dan mengedarkan di antara mereka beban positif.
Boleh melayani anda: Neodymium: struktur, sifat, kegunaanOleh itu, h3Sama ada+ dan h+ Mereka membina hubungan yang ingin tahu dengan molekul air, di luar keasidan.
Awak keluar
Sama seperti bilik oxy organik wujud, tidak terkecuali dengan oxy yang diperolehi dari protonasi air. Formula umumnya ialah [h3Sama ada+] [X-], Di mana x- Ia adalah anion yang berasal dari pembubaran asid yang sangat kuat.
Garam ini kadang -kadang menerima nama 'asid monohidrat', kerana formula [h3Sama ada+] [X-] atau h3Sama ada+· X- Ia juga boleh ditulis sebagai hx · h2Sama ada. Oleh itu, mungkin terdapat asid dihidrat, HX · 2H2Atau, trihydrates, hx · 3h2Atau, dll.
Sebagai contoh, HCl boleh mengkristal sebagai HCl · H2O h3Sama ada+· Cl-. Kami juga mempunyai garam hidronium lain seperti H3Sama ada+· Clo4- atau hclo4· H2Atau, dan hbr · 4h2O h3Sama ada+· Br-· 3h2Sama ada.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia InorgánICA. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Hydronium. Diperoleh dari: dalam.Wikipedia.org
- Avneet kahlon & stephen lebih rendah. (15 Ogos 2020). Ion hidronium. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Helmestine, Anne Marie, Ph.D. (25 Ogos, 2020). Definisi ion hidronium. Pulih dari: Thoughtco.com
- Editor enyclopaedia Britannica. (2020). Ion hidrogen. Pulih dari: Britannica.com

