Model mekanikal kuantum atom

- 3154
- 1008
- Kerry Schmitt
Apakah model mekanikal kuantum atom?
Dia Model mekanikal kuantum atom Ia mengandaikan bahawa ini dibentuk oleh nukleus pusat yang dibentuk oleh proton dan neutron. Elektron, beban negatif, bungkus nukleus di kawasan meresap yang dikenali sebagai orbital.
Bentuk dan lanjutan orbital elektronik ditentukan oleh beberapa magnitud: potensi teras dan tahap tenaga dan momentum elektron sudut kuantiti.
 Rajah 1. Model atom helium mengikut mekanik kuantum. Ia terdiri daripada awan kebarangkalian dua elektron helium yang mengelilingi nukleus positif 100 ribu kali lebih kecil. Sumber: Wikimedia Commons.
Rajah 1. Model atom helium mengikut mekanik kuantum. Ia terdiri daripada awan kebarangkalian dua elektron helium yang mengelilingi nukleus positif 100 ribu kali lebih kecil. Sumber: Wikimedia Commons. Menurut mekanik kuantum, elektron mempunyai tingkah laku gelombang ganda dan skala atom adalah meresap dan tidak spesifik. Dimensi atom secara praktikal ditentukan oleh lanjutan orbital elektronik yang mengelilingi nukleus positif.
Rajah 1 menunjukkan struktur atom helium, yang mempunyai nukleus dengan dua proton dan dua neutron. Nukleus ini dikelilingi oleh awan kebarangkalian kedua -dua elektron yang mengelilingi nukleus, yang seratus ribu kali lebih kecil. Dalam imej berikut, anda dapat melihat atom helium, dengan proton dan neutron dalam nukleus dan elektron dalam orbital.

Saiz atom helium adalah susunan a Angstrom (1 Å), iaitu 1 x 10^-10 m. Walaupun saiz nukleusnya adalah urutan a femtometer (1 fm), iaitu 1 x 10^-15 m.
Walaupun begitu kecil, 99.9% berat atom tertumpu dalam nukleus kecil. Ini kerana proton dan neutron adalah 2,000 kali lebih berat daripada elektron yang mengelilinginya.
Boleh melayani anda: 31 jenis daya dalam fizik dan ciri merekaSkala atom dan tingkah laku kuantum
Salah satu konsep yang mempunyai pengaruh yang paling kepada perkembangan model atom adalah dualitas Gelombang - zarah: Penemuan bahawa setiap objek material mempunyai gelombang perkara yang berkaitan.
Formula yang membolehkan panjang gelombang dikira λ Berkaitan dengan objek material dicadangkan oleh Louis de Broglie pada tahun 1924 dan adalah seperti berikut:
λ = h / (m v)
Di mana h Ia adalah pemalar Planck, m adunan dan v kelajuan.
Menurut prinsip De Broglie, setiap objek mempunyai tingkah laku ganda, tetapi bergantung pada skala interaksi, kelajuan dan jisim, tingkah laku gelombang dapat lebih unggul daripada zarah atau sebaliknya.
Elektron adalah cahaya, jisimnya adalah 9.1 × 10^-31 kg. Kelajuan biasa elektron adalah 6000 km/s (lima puluh kali kurang daripada kelajuan cahaya). Kelajuan ini sepadan dengan nilai tenaga dalam julat berpuluh-puluh elektron-voltio.
Dengan data terdahulu, dan dengan menggunakan formula de Broglie, panjang gelombang untuk elektron dapat diperoleh:
λ = 6.6 x 10^-34 j s / (9.1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektron ke tenaga tipikal tahap atom, mempunyai panjang gelombang dari urutan magnitud yang sama seperti skala atom, sehingga pada skala itu ia mempunyai tingkah laku zarah dan bukan zarah.
Model kuantum pertama
Dengan idea bahawa elektron skala atom mempunyai tingkah laku beralun, model atom pertama berdasarkan prinsip kuantum telah dibangunkan. Antaranya, model atom Bohr menonjol, yang sempurna meramalkan spektrum pelepasan hidrogen, tetapi bukannya atom lain.
Boleh melayani anda: Usaha ketegangan: formula dan persamaan, pengiraan, latihanModel Bohr dan seterusnya Sommerfeld, adalah model separa klasik. Iaitu, elektron adalah sebagai zarah yang tertakluk kepada daya tarikan elektrostatik nukleus yang mengorbit di sekelilingnya, yang ditadbir oleh undang -undang kedua Newton.
Selain itu ke orbit klasik, model pertama ini mengambil kira bahawa elektron mempunyai gelombang bahan yang berkaitan. Hanya orbit yang perimeternya adalah integer panjang gelombang dibenarkan, kerana mereka yang tidak memenuhi kriteria ini pudar oleh gangguan yang merosakkan.
Oleh itu, kuantisasi tenaga dalam struktur atom muncul buat kali pertama.
Perkataan itu kuantum tepatnya berasal dari fakta bahawa elektron hanya boleh mengambil beberapa nilai tenaga diskret dalam atom. Ini bertepatan dengan penemuan Planck, yang terdiri daripada penemuan bahawa radiasi kekerapan F Berinteraksi dengan perkara dalam pakej tenaga E = h f, di mana h Ia adalah pemalar Planck.
Bentuk dan saiz orbital
Skop radial orbital ditentukan oleh Fungsi gelombang RADIkepada. Lebih besar setakat bahawa tenaga elektron tumbuh, iaitu, setakat mana bilangan kuantum utama meningkat.
Jarak radial biasanya diukur dalam radio Bohr, yang untuk tenaga hidrogen terendah ialah 5.3 x 10-11 m = 0.53 Å.
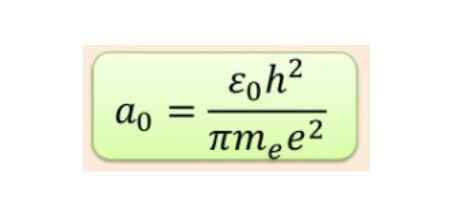 Rajah 2. Formula Bohr Radius. Sumber: f. Zapata.
Rajah 2. Formula Bohr Radius. Sumber: f. Zapata. Tetapi bentuk orbital ditentukan oleh nilai bilangan kuantum momentum sudut. Sekiranya l = 0 anda mempunyai orbital sfera yang dipanggil s, jika l = 1 anda mempunyai orbital lobed yang dipanggil p, yang boleh mempunyai tiga orientasi mengikut nombor kuantum magnet. Angka berikut menunjukkan bentuk orbital.
Boleh melayani anda: magnitud vektor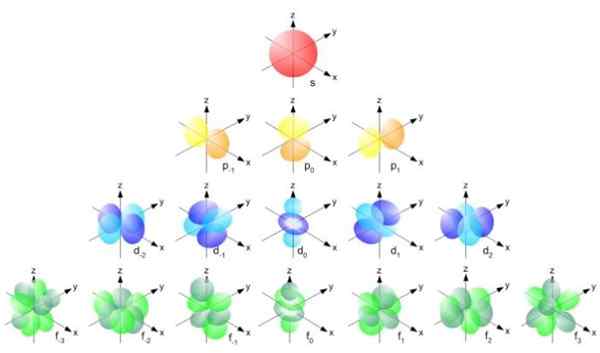 Rajah 3. Bentuk orbital s, p, d, f. Sumber: Ucdavis Chemwiki.
Rajah 3. Bentuk orbital s, p, d, f. Sumber: Ucdavis Chemwiki. Orbital ini dibungkus dalam yang lain mengikut tenaga elektron. Sebagai contoh, angka berikut menunjukkan orbital dalam atom natrium.
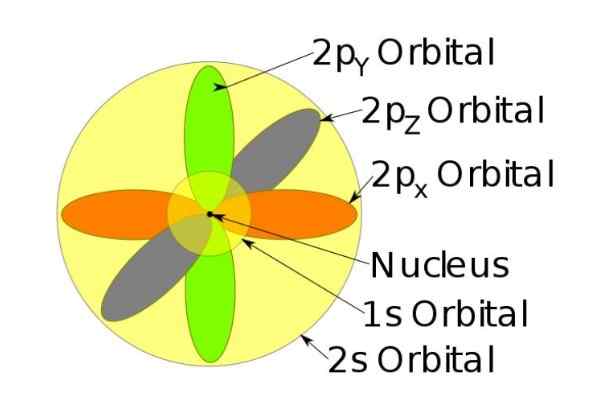 Rajah 4. Orbitals 1s, 2s, 2p ion natrium apabila ia telah kehilangan elektron. Sumber: Wikimedia Commons.
Rajah 4. Orbitals 1s, 2s, 2p ion natrium apabila ia telah kehilangan elektron. Sumber: Wikimedia Commons. Putaran
Model mekanikal kuantum persamaan Schrödinger tidak menggabungkan putaran elektron. Tetapi Pauli diambil kira melalui prinsip pengecualian, yang menunjukkan bahawa orbital dapat mengisi sehingga dua elektron dengan nombor putaran kuantum s = +½ dan s = -½.
Sebagai contoh, ion natrium mempunyai 10 elektron, iaitu, jika kita merujuk kepada angka sebelumnya, terdapat dua elektron untuk setiap orbital.
Tetapi jika ia adalah atom natrium neutral, terdapat 11 elektron, yang terakhir akan menduduki orbital 3s (tidak ditunjukkan dalam angka dan jejari yang lebih besar daripada 2s). Putaran atom adalah tegas dalam ciri -ciri magnet bahan.
Rujukan
- Alonso - Finn. Asas kuantum dan statistik. Addison Wesley.
- Eisberg - Resnick. Fizik kuantum. Limusa - Wiley.
- Gatiorowicz. Fizik kuantum. John Wiley & Sons.
- HSC. Kursus Fizik 2. Jacaranda Plus.
- Wikipedia. Model Atom Schrodinger. Pulih dari: wikipedia.com

