Molality

- 4446
- 591
- Delbert Dare
Apa itu moleality?
The Molality, dilambangkan dengan huruf m dalam huruf kecil, ia adalah istilah yang digunakan untuk menggambarkan kepekatan penyelesaian. Ia boleh ditakrifkan sebagai bilangan tahi lalat larut yang dibubarkan dalam 1 kilogram pelarut.
Ia sama dengan tahi lalat larut (bahan yang larut) dibahagikan dengan kilogram pelarut (bahan yang digunakan untuk larut).

Di mana tahi lalat dilarutkan oleh persamaan:
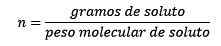
Jadi, pada akhirnya, persamaan moleity tetap
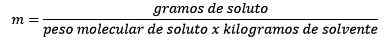
Ciri -ciri moleality
- Molality adalah ukuran kepekatan larut dalam penyelesaian. Terutamanya digunakan apabila suhu adalah kebimbangan.
- Molaliti tidak sama seperti rakan sejawatnya, molariti (tahi lalat untuk setiap liter pelarut), tetapi digunakan dalam pengiraan yang sangat spesifik, terutamanya berkaitan dengan sifat -sifat koligatif (ketinggian titik didih, kemurungan titik pembekuan). Oleh kerana jumlahnya tertakluk kepada variasi kerana suhu dan tekanan, molariti juga berbeza mengikut suhu dan tekanan.
- Dalam beberapa kes, penggunaan berat badan adalah kelebihan kerana jisim tidak berbeza dengan keadaan persekitaran.
- Adalah penting bahawa jisim pelarut dan bukan jisim penyelesaiannya digunakan.
- Penyelesaian yang ditandai dengan kepekatan moral ditunjukkan dengan huruf kecil m. Penyelesaian 1.0 m mengandungi 1 mol larut per kilogram pelarut.
- Penyediaan penyelesaian moral yang diberikan mudah kerana ia hanya memerlukan skala yang baik. Kedua -dua pelarut dan larutan bercampur, bukannya diukur dengan kelantangan.
Ia dapat melayani anda: asid propana- Unit Si (Sistem Antarabangsa) untuk Moleity adalah mol/kg, atau moles larut per kg pelarut. Penyelesaian dengan moleity 1 mol/kg sering digambarkan sebagai "1 mol" atau "1 m".
Walau bagaimanapun, berikutan sistem unit SI, Institut Piawaian dan Teknologi Kebangsaan, yang merupakan kuasa Amerika Syarikat mengenai pengukuran, menganggap bahawa istilah "moral" dan simbol unit "m" adalah usang dan mencadangkan menggunakan mol/kg.
Perbezaan dan persamaan antara moleality (m) dan molariti (m)
Penyediaan penyelesaian moral yang diberikan membayangkan menimbang kedua -dua larutan dan pelarut dan memperoleh massa.
Tetapi dalam hal molaritas, isipadu larutan diukur, yang meninggalkan ruang untuk variasi ketumpatan akibat keadaan keadaan alam sekitar dan tekanan.
Ini bermaksud bahawa ia adalah tekanan yang berfaedah sementara doh tetap tidak berubah.
Di samping itu, tindak balas kimia berlaku dalam perkadaran besar -besaran, dan bukan kelantangan. Untuk bergantung pada doh, molealitas dengan mudah boleh menjadi nisbah massa atau pecahan massa.
Untuk penyelesaian berair (penyelesaian di mana air adalah pelarut) berhampiran suhu ambien, perbezaan antara penyelesaian moral dan molar adalah hina.
Ini kerana sekitar suhu ambien, air mempunyai ketumpatan 1 kg / l. Ini bermaksud bahawa "oleh L" molariti adalah sama dengan "oleh kg" moleality.
Ia boleh melayani anda: kalsium kaseinat: struktur, sifat, mendapatkan dan kegunaanUntuk pelarut seperti etanol, di mana ketumpatan adalah 0.789 kg / L, larutan 1 m akan menjadi 0.789 m.
Bahagian penting untuk mengingati perbezaannya ialah:
Molariti - M → Moles seliter penyelesaian.
Molality - M → Moles per kilogram pelarut.
Contoh moleality
Contoh 1
Masalah: Apakah moral penyelesaian yang mengandungi 0.086 Moles of NaCl dibubarkan dalam 25.0 g air?
Jawapan: Dalam contoh ini, persamaan moral langsung digunakan:
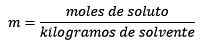
Moles of Solute (NaCl) = 0.086 mol
Jisim (air) = 25.0 g = 25.0 x 10-3 kg
Menggantikan anda mempunyai:
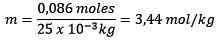
Contoh 2
Masalah: Apakah moral penyelesaian jika 124.2 gram NaOH dibubarkan dalam 1.00 liter air? (Ketumpatan air sama dengan 1.00 g/ml).
Jawapan: Air dikenali sebagai pelarut sejagat dan ketumpatan biasanya diberikan kira -kira 1.00 gram per mililiter, atau apa yang sama, 1 kilogram seliter. Ini memudahkan penukaran dari liter ke kilogram.
Dalam masalah ini, 124.2 gram NaOH perlu ditukar menjadi tahi lalat (untuk tahi lalat larut) dan satu liter air perlu diubah menjadi kilogram (oleh kilogram pelarut) menggunakan ketumpatan.
Pertama, terdapat jisim molar Naoh:
P.mNa= 22.99 g/mol
P.mSama ada= 16 g/mol
P.mH= 1g/mol
P.mNaOH= 22.99 g/mol +16 g/mol +1 g/mol = 39.99 g/mol
Kedua, gram NaOH diubah menjadi tahi lalat, menggunakan adunan molar:
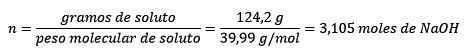
Ketiga, liter air menjadi kilogram menggunakan ketumpatan:
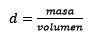
Membersihkan adunan, kekal:
Boleh melayani anda: Emas Oxide (III) (Au2O3): Apakah, Struktur, Hartanah, Kegunaan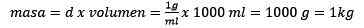
Akhirnya, persamaan molelisme diselesaikan:
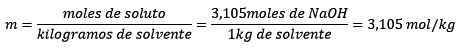
Contoh 3
Masalah: Berapakah jisim air larutan berair yang mengandungi 0.52 gram barium chloride (BACL2, PM = 208.23 g/mol) yang kepekatannya ialah 0.005 mol/kg?
Jawapan: Dalam hal ini kepekatan moral digunakan untuk menentukan jumlah air dalam larutan.
Pertama, bilangan tahi lalat BACL diperoleh2 Dalam penyelesaian:
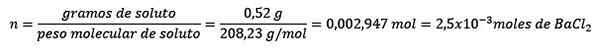
Kedua, kilogram pelarut dibersihkan dari persamaan molelisme dan diselesaikan.
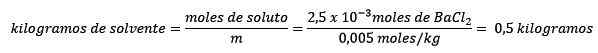
Rujukan
- Mengira masalah contoh molaliti. Pulih dari Sciententes.org.
- Apa contoh molaliti? Pulih dari Socratic.org.
- (S.F.). Moral. Pulih dari tak terbatas.com.

