Momen dipolar bagaimana ia dikira dan contohnya

- 1372
- 141
- Erick Krajcik
Dia Momen dipolar Ia adalah harta kimia yang menunjukkan betapa heterogen caj elektrik diedarkan dalam molekul. Ia dinyatakan dalam unit Debye, 3.33 · 10-30 C · m, dan biasanya nilai mereka berkisar antara 0 hingga 11 d.
Sebatian kutub cenderung mempunyai momen dipole yang besar; Walaupun momen apolar, kecil dipole. Lebih terpolarisasi caj elektrik berada dalam molekul, semakin besar momen dipole; iaitu, mesti ada rantau yang kaya dengan elektron, δ-, dan miskin lain dalam elektron, δ+.
 Draf dua warna berfungsi sebagai analogi kepada dua tiang, positif dan negatif, dari molekul dengan momen dipole yang ditandakan. Sumber: Pexels.
Draf dua warna berfungsi sebagai analogi kepada dua tiang, positif dan negatif, dari molekul dengan momen dipole yang ditandakan. Sumber: Pexels. Momen dipole, μ, adalah magnitud vektor, jadi ia dipengaruhi oleh sudut pautan dan, secara umum, oleh struktur molekul.
Apabila molekul linear, ia boleh dibandingkan dengan draf dua warna. Akhir negatif δ-, ia akan sesuai dengan warna merah; Walaupun positif, δ+, akan menjadi warna biru. Oleh kerana magnitud beban negatif meningkat dalam tiang δ, dan jarak yang memisahkannya dari δ+, momen dipole meningkat.
Secara kimia di atas bermakna bahawa semakin besar perbezaan elektronegativiti antara dua atom, dan semakin lama jarak yang memisahkannya, semakin besar momen dipole di antara mereka.
[TOC]
Bagaimana momen dipole dikira?
Ia dianggap sebagai hubungan kovalen antara dua atom, A dan B:
A-B
Jarak antara beban separa positif dan negatif telah ditakrifkan oleh panjang pautannya:
Keδ+-Bδ-
Kerana proton dan elektron mempunyai magnitud yang sama dengan cas elektrik tetapi dengan tanda bertentangan, 1.6 · 10-19C, ini adalah yang diambil kira ketika menilai momen dipole antara a dan b melalui persamaan berikut:
Ia boleh melayani anda: perbezaan antara sebatian organik dan bukan organikμ = δ ·d
Di mana μ adalah momen dipole, δ adalah beban elektron tanpa tanda negatif, dan d Panjang pautan yang dinyatakan dalam meter. Contohnya, dengan mengandaikannya d Ia mempunyai nilai 2 Å (1 · 10-10m) Momen dipole, μA-B akan:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3.2 · 10-29C · m
Tetapi kerana nilai ini sangat kecil, unit Deby digunakan:
μ = (3.2 · 10-29C · m) · (1 d/3.33 · 10-30 C · m)
= 9.60 d
Nilai μA-B ini boleh mengandaikan bahawa pautan A-B lebih ionik daripada kovalen.
Contoh
Air
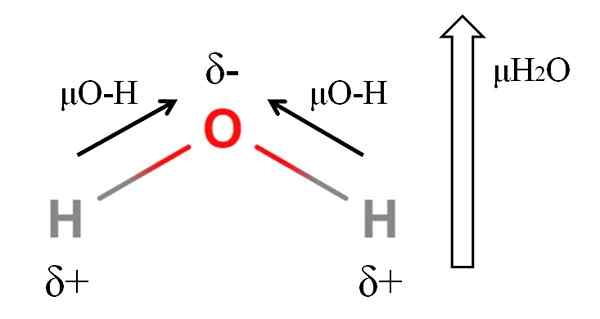 Dipoar Momen Molekul Air. Sumber: Gabriel Bolívar.
Dipoar Momen Molekul Air. Sumber: Gabriel Bolívar. Untuk mengira momen dipole molekul, anda mesti menambah semua momen dipole dari pautan masing -masing, memandangkan sudut pautan dan sedikit trigonometri. Ini pada mulanya.
Air mempunyai salah satu momen dipole terbesar yang boleh dijangkakan untuk sebatian kovalen. Dalam imej atas kita mempunyai atom hidrogen mempunyai beban separa positif, δ+, manakala oksigen membawa beban separa negatif, δ-. Pautan O-H agak kutub (1.5d), dan terdapat dua daripadanya dalam molekul h2Sama ada.
Secara umum, vektor diambil dari atom elektronegatif (H) yang kurang kepada elektronegatif (O). Walaupun mereka tidak ditarik, pada atom oksigen terdapat dua pasang elektron yang tidak dikongsi, yang "menumpukan" rantau negatif lebih banyak lagi.
Kerana geometri sudut H2Atau, detik -detik dipole menyertai arah atom oksigen. Perhatikan bahawa jumlah dua μo-h akan memberikan 3D (1.5+1.5); Tetapi ia tidak seperti itu. Momen air dipole mempunyai nilai eksperimen 1.85d. Berikut adalah kesan sudut dekat 105º antara pautan H-O-H.
Ia boleh melayani anda: Termometer Makmal: Ciri -ciri, Apa itu, Gunakan, ContohnyaMethanol
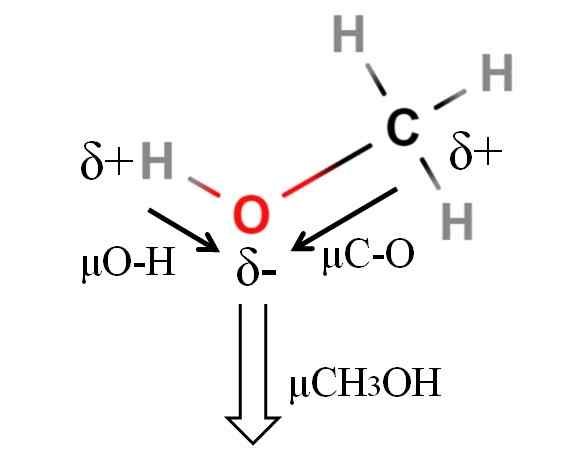 Momen dipoar molekul metanol. Sumber: Gabriel Bolívar.
Momen dipoar molekul metanol. Sumber: Gabriel Bolívar. Momen metanol dipole adalah 1.69d. Kurang dari air. Oleh itu, massa atom tidak mempunyai pengaruh yang terlalu banyak pada saat dipole; Tetapi radio atomnya. Dalam kes metanol, kami tidak dapat mengesahkan bahawa pautan H-O anda mempunyai μ sama dengan 1.5 d; Oleh kerana, persekitaran molekul berbeza di Cho3Oh dan h2Sama ada.
Itulah sebabnya kita perlu mengukur panjang pautan H-O dalam metanol untuk dapat mengira μO-H. Apa yang boleh disahkan ialah μo-h lebih besar daripada μC-o.
Methanol diklasifikasikan sebagai salah satu pelarut paling polar yang dapat ditemui bersama dengan air dan ammonia.
Ammonia
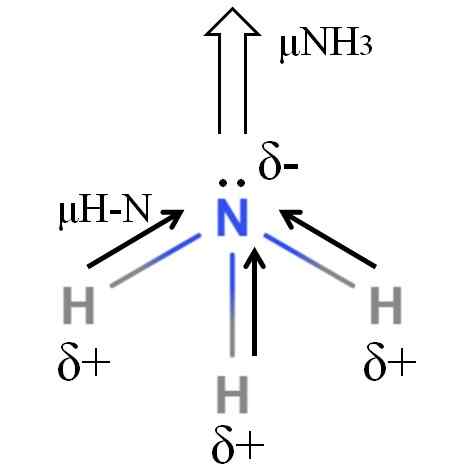 Momen dipoar molekul ammonia. Sumber: Gabriel Bolívar.
Momen dipoar molekul ammonia. Sumber: Gabriel Bolívar. Bon H-N agak kutub, jadi nitrogen berikutan elektronegativiti yang lebih besar menarik elektron ke arah dirinya (imej unggul). Di samping itu, di atasnya, kami mempunyai beberapa elektron yang tidak bersemangat, yang menyumbang beban negatif mereka ke rantau δ-. Oleh itu, caj elektrik mendominasi atom nitrogen ammonia.
Ammonia mempunyai momen dipole 1.42d, kurang daripada metanol. Jika kedua -dua ammonia dan metanol dapat diubah menjadi draf, dapat dilihat bahawa draf metanol mempunyai tiang yang lebih jelas berbanding dengan draf ammonia.
Etanol
Dalam kes etanol, Cho3Ch2Oh momen dipole anda sangat dekat dengan metanol, tetapi ia cenderung mempunyai nilai yang lebih rendah. Mempunyai lebih banyak atom karbon yang mengarang rantau δ+, atom oksigen yang mewakili δ-, mula kehilangan sedikit "intensiti negatif relatif".
Boleh melayani anda: dimethylamine ((CH3) 2NH): struktur, sifat, kegunaan, risikoKarbon dioksida
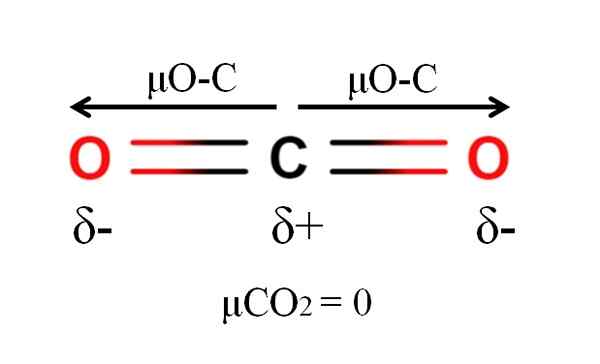 Momen Dipoar Molekul Karbon Dioksida. Sumber: Gabriel Bolívar.
Momen Dipoar Molekul Karbon Dioksida. Sumber: Gabriel Bolívar. Karbon dioksida mempunyai dua ikatan kutub, c = o, dengan momen dipole masing-masing μo-c. Walau bagaimanapun, seperti yang dapat dilihat dalam imej yang unggul, geometri linear CO2 menjadikan kedua-dua μO-C secara vektori membatalkan satu sama lain, walaupun karbon mempunyai beban separa positif dan beban separa negatif oksigen.
Atas sebab ini, karbon dioksida adalah molekul apolar, kerana μCO2 mempunyai nilai 0D.
Metana
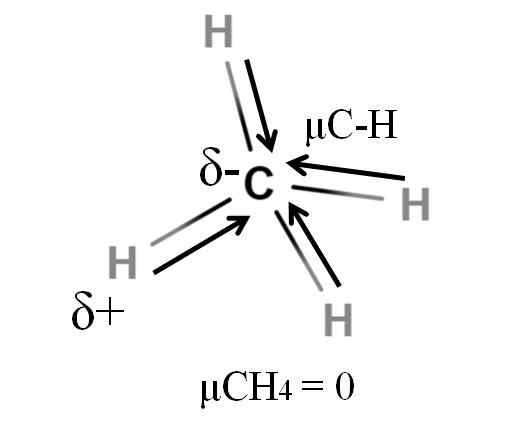 Momen dipolar untuk molekul metana. Sumber: Gabriel Bolívar.
Momen dipolar untuk molekul metana. Sumber: Gabriel Bolívar. Kedua -dua metana dan karbon dioksida berkongsi sesuatu yang sama: mereka adalah molekul yang sangat simetri. Secara umum, molekul yang lebih simetri, semakin kurang momen dipole.
Sekiranya kita melihat molekul cho4, Ikatan C-Hnya adalah kutub, dan elektron diarahkan ke arah atom karbon kerana ia sedikit lebih elektronegatif. Ia boleh dianggap bahawa karbon perlu menjadi rantau δ yang sangat negatif; Sebagai draf dengan pusat merah yang sengit dan kebiruannya berakhir.
Walau bagaimanapun, apabila Cho dibahagikan4 Pada separuh kita akan memperoleh dua bahagian H-C-H, satu di sebelah kiri dan yang lain kanan, sama dengan molekul H2Sama ada. Oleh itu, momen dipole terhasil daripada menambahkan kedua-dua μC-h ini dibatalkan dengan separuh lagi. Dan oleh itu, μch4 mempunyai nilai 0D.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Walter J. Moore. (1963). Kimia Fizikal. Dalam kinetik kimia. Edisi keempat, Longmans.
- Iran. Levine. (2009). Prinsip Fizikokimia. Edisi Keenam, halaman 479-540. MC Graw Hill.
- Helmestine, Anne Marie, Ph.D. (29 Januari 2020). Definisi momen dipole. Pulih dari: Thoughtco.com
- Blaber Mike. (29 September 2019). Dipole Moments. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Larita Williams. (2020). Momen Dipole: Definisi, Persamaan & Contoh. Kajian. Pulih dari: belajar.com
- Wikipedia. (2020). Momen dipole bon. Diperoleh dari: dalam.Wikipedia.org
- « Gaslighting cara mengesannya dan 5 petua untuk mengelakkannya
- Ciri -ciri, Fungsi, Jenis, Contoh Onomatopoeia »

