Struktur oksigen molekul, sifat, kegunaan
- 3854
- 260
- Ismael Turner
Dia Oksigen molekul Sama ada Dioxygen, Juga dipanggil oksigen diatomik atau gas, ia adalah bentuk asas yang paling biasa di mana elemen ini terdapat di planet bumi. Formulanya atau2, oleh itu menjadi molekul diatomik dan homonuklear, benar -benar apolar.
Udara yang kita nafas terdiri daripada kira -kira 21% oksigen sebagai molekul atau2. Semakin kita naik, kepekatan pengurangan oksigen gas, dan meningkatkan kehadiran ozon, atau3. Badan kita mengambil kesempatan daripada o2 Untuk mengoksigenkan tisu anda dan melakukan pernafasan selular.
 Tanpa oksigen memperkayakan kehidupan suasana kita akan menjadi fenomena yang tidak mampan. Sumber: Pixabay.
Tanpa oksigen memperkayakan kehidupan suasana kita akan menjadi fenomena yang tidak mampan. Sumber: Pixabay. O2 Dia juga bertanggungjawab atas kewujudan api: tanpa dia hampir mustahil untuk memiliki kebakaran dan pembakaran. Ini kerana harta utamanya adalah menjadi ejen pengoksidaan yang kuat, memenangi elektron atau mengurangkan molekul air, atau dalam anion oksida, atau2-.
Oksigen molekul adalah penting untuk proses aerobik yang tidak terkira banyaknya, mempunyai aplikasi dalam rawatan metalurgi, perubatan dan air kumbahan. Gas ini praktikal sinonim dengan haba, pernafasan, pengoksidaan dan, sebaliknya, suhu beku ketika ada dalam keadaan cairnya.
[TOC]
Struktur oksigen molekul
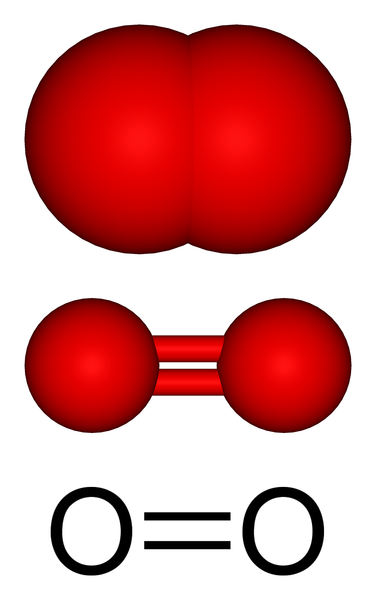
 Struktur molekul oksigen gas. Sumber: Benjah-bmm27 melalui Wikipedia.
Struktur molekul oksigen gas. Sumber: Benjah-bmm27 melalui Wikipedia. Di bahagian atas, kita mempunyai struktur molekul oksigen gas yang diwakili dengan beberapa model. Dalam dua yang terakhir, ciri -ciri ikatan kovalen yang menyimpan atom oksigen dibuktikan: ikatan ganda o = o, di mana setiap atom oksigen melengkapkan oktet valencianya.
Boleh melayani anda: diasstreomersMolekul atau2 Ia linear, homonuklear dan simetri. Ikatan berganda mempunyai panjang 121 malam. Jarak pendek ini menjadikan tenaga tertentu yang diperlukan (498 kJ/mol) untuk memecahkan pautan o = o, dan oleh itu adalah molekul yang agak stabil.
Jika ya, oksigen atmosfera akan sepenuhnya terdegradasi dari masa ke masa, atau udara tidak akan terbakar.
Sifat
Penampilan fizikal
Oksigen molekul adalah gas yang tidak berwarna, tidak enak dan tidak berbau, tetapi ketika memeluwap dan mengkristal memperoleh nada kebiruan.
Jisim molar
32 g/mol (nilai bulat)
Takat lebur
-218 ºC
Takat didih
-183
Kelarutan
Oksigen molekul tidak terlalu larut dalam air, tetapi cukup untuk menyokong fauna marin. Sekiranya kelarutan anda lebih besar, ia akan kurang berkemungkinan mati akibat lemas. Sebaliknya, kelarutannya jauh lebih besar dalam minyak dan cecair apolar, dapat mengoksidakannya dengan perlahan dan dengan itu mempengaruhi sifat asalnya.
Negeri tenaga
Oksigen molekul adalah bahan yang tidak dapat digambarkan sepenuhnya oleh teori pautan valencia (TEV).
Konfigurasi oksigen elektronik adalah seperti berikut:
[Dia] 2s² 2p⁴
Ia mempunyai sepasang elektron yang hilang (atau :). Apabila dua atom oksigen dijumpai, ia dikaitkan dengan membentuk ikatan ganda o = o, melengkapkan kedua -dua oktet Valencia.
Oleh itu, molekul atau2 Ia harus diamagnet, dengan semua elektron yang berpasangan. Walau bagaimanapun, ia adalah molekul paramagnet, dan ini dijelaskan oleh gambarajah orbital molekulnya:
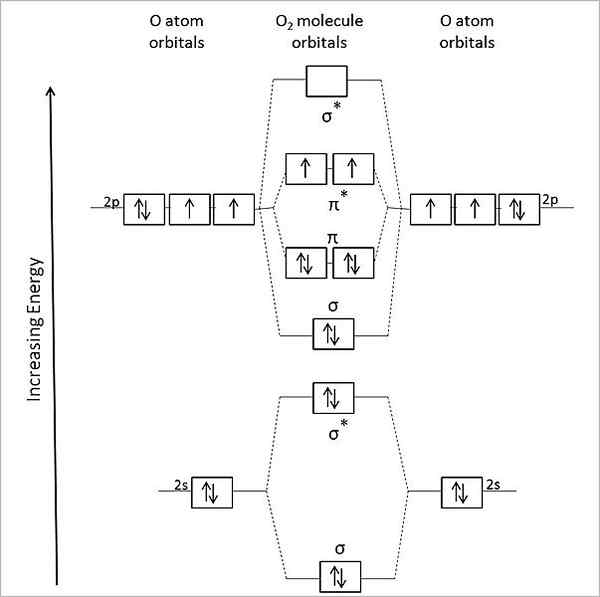 Rajah orbital molekul untuk oksigen gas. Sumber: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Rajah orbital molekul untuk oksigen gas. Sumber: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) Oleh itu, teori orbit molekul (TOM) lebih baik menerangkan atau2. Dua elektron yang hilang terletak di orbital molekul π*, tenaga yang lebih besar, dan memberikan oksigen dengan watak paramagnetik mereka.
Boleh melayani anda: methylamine: struktur, sifat, pengeluaran, kegunaanMalah, keadaan tenaga ini sepadan dengan oksigen triplet, 3Sama ada2, Yang paling utama dari semua. Keadaan tenaga oksigen yang lain, kurang banyak di bumi, adalah satu, 1Sama ada2.
Transformasi
Oksigen molekul jauh stabil selagi ia tidak bersentuhan dengan mana -mana bahan yang terdedah kepada pengoksidaan, lebih kurang jika tidak ada sumber panas yang kuat, seperti percikan api. Ini kerana o2 Ia mempunyai kecenderungan yang tinggi untuk mengurangkan, memperoleh elektron dari atom atau molekul lain.
Apabila dikurangkan, ia dapat mewujudkan spektrum pautan dan bentuk yang luas. Jika ia membentuk ikatan kovalen, ia akan melakukannya dengan kurang atom elektronegatif daripada dia, termasuk hidrogen, untuk berasal dari air, h-o-h. Ia juga boleh menjadi alam semesta karbon, untuk menyebabkan ikatan C-O dan beberapa jenis molekul organik oksigen (éteres, keton, aldehid, dll.).
O2 Anda juga boleh mendapatkan elektron untuk mengubah peroksida dan superoksida, atau22- I2-, masing -masing. Apabila ia menjadi peroksida dalam organisma, hidrogen peroksida diperoleh, h2Sama ada2, H-O-O-H, sebatian berbahaya yang diproses oleh tindakan enzim tertentu (peroksidase dan catalas).
Sebaliknya, dan sekurang -kurangnya, o2 bertindak balas dengan bahan bukan organik untuk menjadi anion oksida, atau2-, Mengarang senarai jisim mineralogi yang tidak berkesudahan yang membengkak kulit dan mantel tanah.
Aplikasi
Kimpalan dan pembakaran
 Oksigen digunakan untuk pembakaran asetilena dan api api panas panas yang berharga dalam kimpalan. Sumber: Sheila/CC oleh (https: // creativeCommons.Org/lesen/by/2.0)
Oksigen digunakan untuk pembakaran asetilena dan api api panas panas yang berharga dalam kimpalan. Sumber: Sheila/CC oleh (https: // creativeCommons.Org/lesen/by/2.0) Oksigen digunakan untuk menjalankan tindak balas pembakaran, di mana bahan secara eksotermik mengeluarkan api. Kebakaran ini dan suhunya berbeza -beza bergantung kepada bahan yang terbakar. Oleh itu, api yang sangat panas dapat diperoleh, seperti acetylene (di atas), dengan mana logam dan aloi dikimpal.
Boleh melayani anda: entalpiJika tidak untuk oksigen, bahan api tidak dapat membakar dan memberikan semua tenaga kalori mereka, digunakan untuk melepaskan roket, atau untuk memulakan kereta.
Ejen oksidan dalam kimia hijau
Terima kasih kepada gas ini, oksida organik dan bukan organik yang tidak berkesudahan disintesis atau dihasilkan secara industri. Reaksi ini berdasarkan kuasa pengoksidaan oksigen molekul, juga salah satu reagen kimia hijau yang paling berdaya maju untuk mendapatkan produk farmaseutikal.
Rawatan pernafasan dan air sisa yang dibantu
Oksigen adalah penting untuk memenuhi permintaan pernafasan pada pesakit dengan keadaan kesihatan yang serius, dalam penyelam ketika mereka turun pada kedalaman yang rendah, dan di pendaki gunung, yang ketinggalan kepekatan oksigen kelihatan berkurang secara dramatik.
Begitu juga, bakteria aerobik "memberi" oksigen, yang membantu merendahkan sisa yang tercemar dari air kumbahan, atau membantu menghirup ikan, dalam tanaman berair untuk perlindungan atau perdagangan.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Allotropes oksigen. Diperoleh dari: dalam.Wikipedia.org
- Mengasah, c.Ke., Kappe, c.Sama ada. (2019). Penggunaan oksigen molekul untuk pengoksidaan aerobik fasa cecair dalam aliran berterusan. Curr chem atas (z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28 Januari 2020). 10 kegunaan untuk oksigen. Pulih dari: saintifik.com
- Cliffsnotes. (2020). Biokimia I: Kimia Oksigen Molekul. Pulih dari: cliffsnotes.com
- Bekalan Perindustrian GZ. (2020). Manfaat Perindustrian Gas Oksigen. Diperolehi daripada: GZ-supplies.com
- « Budaya Tradisi Portugal, Kastam, Gastronomi, Agama
- Formula dan Persamaan Gangguan yang merosakkan, Contoh, Latihan »

