Struktur pepsinogen, fungsi, jenis, sintesis
- 4716
- 1446
- Ms. Micheal Rippin
Dia Pepsinogen Ia adalah zimogen pepsin, salah satu enzim hidrolisis utama yang bertanggungjawab melakukan pencernaan protein di perut mamalia. Zimogen atau proenzim adalah prekursor enzimatik yang tidak aktif, iaitu, mereka tidak dapat memangkin tindak balas yang dilakukan oleh bentuk aktif mereka.
Pengaktifannya bergantung kepada perubahan dalam struktur tiga dimensi protein yang menimbulkan pembentukan tapak aktif berfungsi. Perubahan ini, dalam kebanyakan kes, bertepatan dengan pecah proteolitik segmen protein.
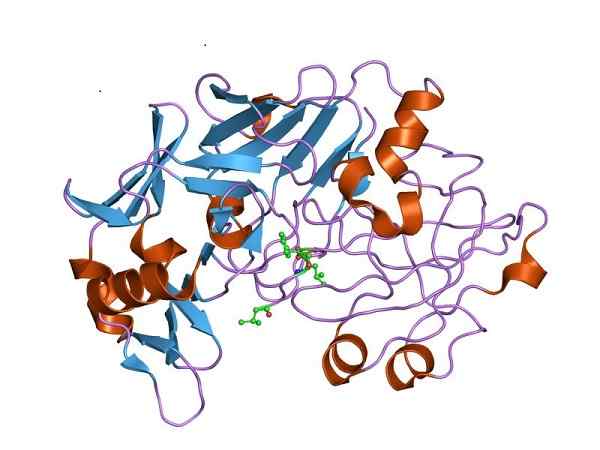
 Struktur pepsin tiga dimensi, bentuk pepsinogen aktif secara aktif. Oleh Jawahar Swaminathan dan kakitangan MSD di Institut Bioinformatik Eropah [Domain Awam (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
Struktur pepsin tiga dimensi, bentuk pepsinogen aktif secara aktif. Oleh Jawahar Swaminathan dan kakitangan MSD di Institut Bioinformatik Eropah [Domain Awam (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Oleh itu, pepsinogen mesti mengalami perubahan struktur untuk memperoleh aktiviti peptidase yang diperlukan dan memihak kepada pencernaan protein di perut, selepas pengambilan makanan.
[TOC]
Struktur
Pepsinogen adalah 371 protein asid amino milik keluarga besar proteinase aspartik, dicirikan dengan menyampaikan sisa asid aspartik di pusat aktifnya.
Struktur Quaternarinya ditentukan untuk kali pertama untuk protein yang dinyatakan dalam babi melalui teknik crystallography x. Hasilnya sama dengan yang dipamerkan oleh bentuk protein yang matang atau aktif, pepsin.
Oleh itu, satu -satunya perbezaan yang dijumpai ialah kehadiran dalam pepsinogen peptida asid amino 44 yang melipat di atas celah tapak aktif. Dalam kedudukan ini, ia menghalang interaksi protease ini dengan protein untuk dihina.
Peptida ini yang akan dipertikaikan untuk menimbulkan enzim aktif, terletak di akhir terminal amino protein.
Oleh kerana ia berfungsi hanya sebagai topi, ketidakupayaan pepsinogen protein yang merendahkan tidak disebabkan oleh ubah bentuk struktur pusat aktif. Sebaliknya, ini kekal dengan penyesuaian yang sama dalam kedua -dua bentuk enzim.
Boleh melayani anda: Glucans: Struktur, Ciri dan FungsiDalam pengertian ini, perlu diperhatikan bahawa struktur kristal pepsinogen merupakan model anggaran struktur zimogeno lain milik keluarga besar protein aspartik.
Fungsi
Pada permulaan kehidupan, pepsin (bentuk aktif pepsinogen) penting untuk pencernaan susu. Selanjutnya, fungsinya adalah untuk merendahkan protein diet di konstituen mereka (asid amino) untuk memudahkan penyerapan mudah mereka.
Sintesis dan rembesan
Pepsinogen disintesis oleh sel -sel utama dan sel -sel fundik mukosa gastrik. Selanjutnya, ia disimpan dalam vesikel sekretori yang kekal di sitoplasma sel -sel ini sehingga saat pelepasan mereka diperlukan.
Oleh itu, rembesan zimogen ini adalah proses yang dikawal selia. Pembebasan vesikelnya, penduduk sitosol melalui exocytosis, memerlukan rangsangan hormon dan saraf. Peningkatan tahap enzim gastrik merembes dan gastrin, serta asetilkolin, cholecystoquinine, faktor pertumbuhan epidermis dan oksida nitrik merangsang sintesis dan rembesan mereka.
Di samping itu, eksperimen yang dijalankan dengan sel ATT20, sel sel yang biasa digunakan dalam kajian jalan rembesan di mamalia, telah menunjukkan bahawa peningkatan amp kitaran juga dapat mendorong rembesan tersebut.
Sebagai tambahan kepada rembesan normalnya di paras perut, jumlah pepsinogen yang agak rendah telah dikesan dalam darah dan air kencing, itulah sebabnya ia dipanggil uropepsinogen.
Asal uropepsinogen, serta fungsi yang dapat dilakukan di kedua -dua lokasi, kekal tanpa ditentukan. Walau bagaimanapun, ketiadaan mereka pada pesakit yang telah menghilangkan perut sepenuhnya seolah -olah menunjukkan bahawa asal mereka sama -sama perut.
Lelaki
Dua jenis utama pepsinogen telah diterangkan setakat ini: Pepsinogen I dan Pepsinogen II. Kedua -dua jenis tidak menunjukkan perbezaan dalam aktiviti pemangkin mereka dan sama -sama diaktifkan oleh hidrolisis proteolitik yang bergantung kepada asid hidroklorik.
Boleh melayani anda: denaturasi protein: apakah, faktor, akibatnyaPepsinogen I disintesis dan dipisahkan oleh kedua -dua sel utama dan sel -sel fundik mukosa gastrik. Oleh itu, rembesannya berkurangan pada pesakit dengan gastritis kronik atropik, penyakit perut yang dicirikan oleh jumlah kehilangan kelenjar gastrik.
Tidak seperti yang terakhir, pepsinogen II (PGII) disintesis oleh praktikal semua sel yang merupakan sebahagian daripada mukosa gastrik, tetapi lebih menonjol oleh mukosa antral dan mereka yang membentuk kelenjar brünner yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum yang ada di duodenum.
Pada pesakit dengan gastritis kronik atropik, jenis pepsinogen ini mengimbangi penurunan rembesan pepsinogen i.
Kewujudan kedua -dua jenis pepsinogen ini, yang hanya berbeza dengan dirembes oleh sel yang berbeza, mungkin kelihatan berlebihan. Walau bagaimanapun, ia boleh menjadi penyesuaian evolusi untuk menjamin sintesis pepsin apabila perlu.
Pengaktifan
Pepsinogen memperoleh aktiviti pemangkin apabila berubah menjadi pepsin, produk penghapusan 44 peptida asid amino yang terdapat di rongga tapak aktif.
Operasi optimumnya bergantung pada nilai pH yang rendah termasuk dalam julat 1.5 hingga 2. Dalam keadaan fisiologi, nilai -nilai ini dikekalkan oleh rembesan asid hidroklorik dalam saluran intraselular.
Pencernaan asid di paras perut tidak berlaku di semua haiwan, sebagai contoh ini adalah serangga, yang kekurangan pepsinogen. Walau bagaimanapun, vertebrata yang mempunyai perut jika mereka mempunyai aktiviti peptik.
Pepsinogen, yang disimpan dalam vesikel sekretori sel utama, dilepaskan ke saluran gastrik apabila perlu. Sebaik sahaja ia mencapai perut, ia menjadi produk pepsin dari persekitaran berasid dan molekul pepsinogenik aktif ini.
Dengan tindakan gentian saraf intrinsik dan rangsangan ekstrinsik vagal, pengeluaran pepsinogen dirangsang, serta HCl, gastrin dan histamin. Sebaliknya, histamin dan gastrin merangsang sel parietal untuk merembeskan HCl.
Boleh melayani anda: Kain konduktif: Apakah, ciri, fungsiPepsin, seperti semua endopeptidase, bertindak pada hubungan tertentu antara asid amino protein untuk menghasilkan peptida yang lebih kecil.
Dalam kata lain; Hidrolisis ikatan peptida dalaman protein. Tindakannya lebih berkesan dalam pautan peptida dekat dengan asid amino aromatik (phenylalanine, tirosin). Tidak seperti zimogen prekursornya, perubahan adaptif pepsin dalam nilai pH lebih besar daripada 6 menghasilkan penurunan aktiviti pemangkin yang tidak dapat dipulihkan.
Rujukan
- Bryksa BC, Tanaka T, Yada RY. Pengubahsuaian N-terminal Meningkatkan kestabilan neutral pepsin. Biokimia. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Perbandingan struktur utama protessa berasid dan zymogens mereka. Adv exp med biol. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Buku teks fisiologi perubatan. (Edisi ke -11.). Amerika Syarikat: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, Prinsip Perubatan Dalaman. (Edisi ke -16.). Mexico: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Gastritis atropik yang teruk dengan jangkitan Helicobacter pylori dan kanser gastrik. Kanser gastrik. 1998; 1: 118-124.
- Lin Y, Found M, Lin X, Hartsuck JA, Tang J. Ketergantungan pH parameter kinetik pepsin, rhizopuspepsin dan mutan ikatan hidrogen tapak mereka. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat p. Rembesan asid dan penyusunan semula membran dalam sel parietal gastrik tunggal dalam budaya utama. Sel Biologi. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Pembangunan fungsi penyembur gastrik. Fisiologi janin dan neonatal (edisi kelima). Jilid 1, Halaman 881-888.
- Schubert ML. Rahsia Gastrik. Pendapat semasa Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. Struktur molekul dan kristal pepsin porcine monoklinik ditapis pada 1.8 Å Resolusi. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. Epidemiologi tahap pepsinogen serum rendah dan persatuan antarabangsa dengan kadar kanser gastrik. Gastroenterologi. 1994; 107: 1335-1344.
- Wolfe MM, Soll AH. Fisiologi rahsia asid gastrik. N English J Med 1998; 319: 1707.
- « Pembangunan Sel G, Gastrine, Saluran Taip Tipos
- Ciri -ciri Nanche, Habitat, Hartanah, Resipi Memasak »

