Formula proses isobaric, persamaan, eksperimen, latihan

- 1379
- 101
- Ms. Edgar Carroll
Didalam proses isobaric, tekanan P sistem tetap berterusan. Awalan "ISO" berasal dari bahasa Yunani dan digunakan untuk menunjukkan bahawa sesuatu tetap malar, sementara "baros", juga dari bahasa Yunani, bermaksud berat badan.
Proses isobaric sangat milik kedua -dua bekas tertutup dan di ruang terbuka, mudah untuk mencari mereka dalam alam semula jadi. Dengan ini kita bermaksud bahawa perubahan fizikal dan kimia adalah mungkin pada permukaan duniawi atau tindak balas kimia dalam bekas terbuka ke atmosfera.
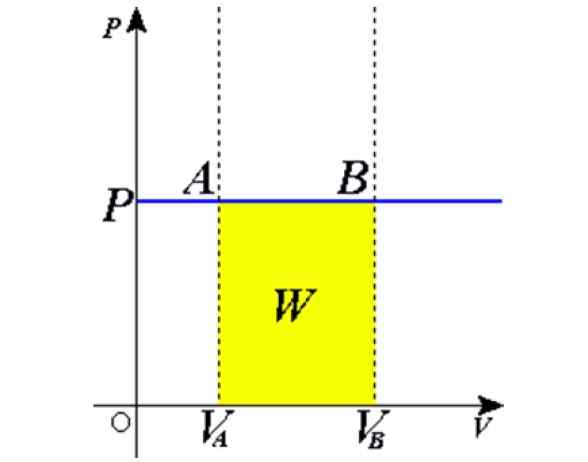 Rajah 1. Proses Isobaric: garis mendatar biru adalah isobara, yang bermaksud tekanan malar. Sumber: Wikimedia Commons.
Rajah 1. Proses Isobaric: garis mendatar biru adalah isobara, yang bermaksud tekanan malar. Sumber: Wikimedia Commons. Beberapa contoh diperoleh dengan pemanasan ke matahari balon yang penuh dengan udara, memasak, mendidih atau air beku, stim yang dihasilkan di dandang atau proses menaikkan belon udara panas. Kemudian kami akan memberi penjelasan mengenai kes -kes ini.
[TOC]
Formula dan persamaan
Kami memperoleh persamaan untuk proses isobaric dengan mengandaikan bahawa sistem di bawah kajian adalah gas yang ideal, model yang cukup sesuai untuk hampir mana -mana gas di kurang daripada 3 atmosfera tekanan. Zarah gas ideal bergerak secara rawak, menduduki keseluruhan jumlah ruang yang mengandungi mereka tanpa berinteraksi antara satu sama lain.
Sekiranya gas ideal terkunci dalam silinder yang disediakan dengan omboh bergerak dibenarkan untuk berkembang dengan perlahan, dapat diandaikan bahawa pada setiap masa zarahnya seimbang. Kemudian gas menggunakan omboh kawasan Ke kekuatan F Magnitud:
F = p.Ke
Di mana p Ia adalah tekanan gas. Kekuatan ini menghasilkan pekerjaan yang menghasilkan anjakan yang sangat kecil Dx Dalam omboh yang diberikan oleh:
dw = fdx = pa.Dx
Seperti produk ADX Ia adalah perbezaan kelantangan Dv, Jadi DW = PDV. Ia tetap untuk mengintegrasikan kedua -dua belah pihak dari jumlah awal VKe Sehingga jumlah akhir VB Untuk mendapatkan jumlah kerja yang dilakukan oleh gas:


[TOC]
Eksperimen
Keadaan yang diterangkan disahkan secara eksperimen mengkonfigurasi gas dalam silinder yang disediakan dengan omboh bergerak, seperti yang ditunjukkan dalam Rajah 2 dan 3. Piston diletakkan di atas omboh, yang beratnya diarahkan, sementara gas menimbulkan daya terima kasih kepada tekanan P yang menghasilkan pada omboh.
Ia boleh melayani anda: Imantation: Apa yang terdiri, kaedah dan contoh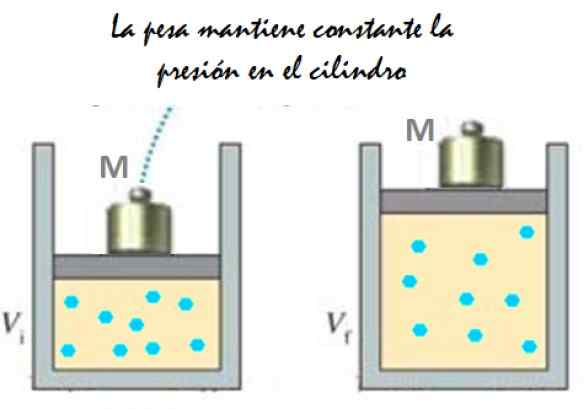 Rajah 2. Eksperimen yang terdiri daripada memperluaskan gas tekanan tetap. Sumber: f. Zapata.
Rajah 2. Eksperimen yang terdiri daripada memperluaskan gas tekanan tetap. Sumber: f. Zapata. Oleh kerana omboh dapat bergerak dengan bebas, jumlah yang diduduki gas dapat berubah tanpa masalah, tetapi tekanan tetap tetap. Menambah tekanan atmosfera pAtm, Itu juga menimbulkan kekuatan, anda mempunyai:
Mg - p.A + pAtm . A = malar
Oleh itu: p = (mg/a) + pAtm Ia tidak berubah, melainkan jika m dan dengan beratnya diubahsuai. Menambah haba ke silinder, gas akan mengembangkan peningkatan jumlahnya atau ia akan berkontrak apabila mengekstrak haba.
Proses isobariik dalam gas ideal
Persamaan status gas yang ideal mengaitkan pembolehubah penting: tekanan p, volum V dan suhu t:
P.V = n .R.T
Di sini n mewakili bilangan tahi lalat dan r adalah pemalar gas ideal (sah untuk semua gas), yang dikira dengan mengalikan pemalar Boltzmann oleh nombor Avogadro, yang mengakibatkan:
R = 8.31 j/mol k
Apabila tekanan adalah malar, persamaan negeri boleh ditulis sebagai:
V/t = nr/p
Tetapi NR/P adalah malar, kerana N, R dan P adalah. Oleh itu, apabila sistem berlalu dari satu negeri 1 ke negeri lain 2, bahagian berikut timbul, juga dikenali sebagai undang -undang Charles:
V1/T1 = V2/T2
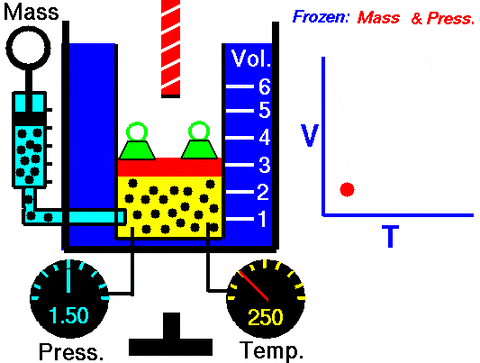 Rajah 3. Animasi yang menunjukkan pengembangan gas tekanan malar. Di sebelah kanan graf kelantangan bergantung pada suhu, iaitu garis. Sumber: Wikimedia Commons. Pusat Penyelidikan Glenn NASA [domain awam].
Rajah 3. Animasi yang menunjukkan pengembangan gas tekanan malar. Di sebelah kanan graf kelantangan bergantung pada suhu, iaitu garis. Sumber: Wikimedia Commons. Pusat Penyelidikan Glenn NASA [domain awam]. Menggantikan W = pΔV, Kerja yang dilakukan untuk pergi dari negeri 1 hingga 2, dari segi pemalar dan variasi suhu, mudah diukur dengan termometer:
W1 → 2 = nr (t2 - T1) = nr.Δt
Sebaliknya, undang -undang termodinamik pertama menetapkan bahawa:
Δu = q - w
Ini bermakna menambah gas sejumlah haba q, tenaga dalaman ΔU meningkat dan getaran molekulnya meningkat. Dengan cara ini, gas mengembang dan melakukan kerja dengan menggantikan omboh, seperti yang telah kita katakan sebelumnya.
Dalam gas monoatomik yang ideal dan variasi tenaga dalaman ΔU, yang merangkumi tenaga kinetik dan tenaga berpotensi molekulnya, adalah:
ΔU = (3/2)Nr Δt
Akhirnya kita menggabungkan satu ungkapan yang telah kita perolehi:
Q = Δu + w = (3/2)Nr Δt + NrΔt = (5/2) Nr Δt
Sebagai alternatif yang boleh ditulis semula dari segi jisim m, perbezaan suhu dan pemalar baru yang dipanggil Haba haba spesifik Pada tekanan berterusan, disingkat cp, Unitnya adalah J/mol k:
Boleh melayani anda: Venus (planet)Q = m cp Δt
Contoh
Tidak semua proses isobariik dijalankan dalam bekas tertutup. Sebenarnya, proses termodinamik yang tidak terhitung banyak jenis tekanan atmosfera berlaku, jadi proses isobariik sangat kerap berlaku. Ini termasuk perubahan fizikal dan kimia di permukaan bumi, tindak balas kimia dalam bekas terbuka dan banyak lagi.
Agar proses isobariik berlaku dalam sistem tertutup, sempadan mereka cukup fleksibel untuk membolehkan perubahan dalam jumlah tanpa tekanan bervariasi.
Inilah yang berlaku dalam eksperimen omboh yang mudah bergerak ketika gas berkembang. Perkara yang sama berlaku dengan melampirkan gas dalam pesta untuk pihak atau belon udara panas.
Di sini kita mempunyai beberapa contoh proses isobaric:
Rebus air dan masak
Air mendidih untuk teh atau sos memasak di bekas terbuka adalah contoh yang baik dalam proses isobaric, kerana semua orang berkembang pada tekanan atmosfera.
Apabila memanaskan air, suhu dan jumlah peningkatan dan jika haba diteruskan, titik mendidih akhirnya dicapai, di mana perubahan fasa air berlaku. Walaupun ini berlaku, suhu juga tetap tetap 100 º c.
Membekukan air
Sebaliknya, air beku juga merupakan proses isobaric, sama ada ia berlaku di tasik semasa musim sejuk atau peti sejuk domestik.
Panaskan belon yang penuh dengan udara ke matahari
Satu lagi contoh proses isobaric ialah perubahan dalam jumlah belon udara yang melambung apabila ia dibiarkan terdedah kepada matahari. Perkara pertama pada waktu pagi, ketika tidak terlalu panas, dunia mempunyai jumlah tertentu.
Apabila masa berlalu dan suhu meningkat, dunia juga memanaskan peningkatan jumlahnya dan semua ini berlaku di bawah tekanan yang berterusan. Bahan Globe adalah contoh yang baik dari sempadan yang cukup fleksibel untuk menjadikan udara di dalam, ketika dipanaskan, mengembang tanpa mengubah tekanan.
Pengalaman juga boleh dilakukan dengan menyesuaikan dunia tanpa inflar di puncak botol kaca penuh dengan satu pertiga air, yang dipanaskan ke Maria Bio of Mary. Sebaik sahaja air dipanaskan, belon itu meningkat segera, tetapi penjagaan harus diambil untuk tidak terlalu panas sehingga tidak meletup.
Belon aerostatik
Ia adalah kapal terapung tanpa pendorong, yang menggunakan arus udara untuk mengangkut orang dan objek. Globe biasanya dipenuhi dengan udara panas, yang lebih sejuk daripada udara sekitar, naik dan berkembang menjadikan dunia kasar.
Boleh melayani anda: titik tigaSemasa arus udara terus ke dunia, ia mempunyai pembakar yang diaktifkan untuk memanaskan gas apabila anda ingin naik atau mengekalkan ketinggian, dan dinyahaktifkan ketika turun atau mendarat. Semua ini berlaku pada tekanan atmosfera, yang sepatutnya tetap pada ketinggian tertentu tidak jauh dari permukaan.
 Rajah 4. Belon udara panas. Sumber: Pixabay.
Rajah 4. Belon udara panas. Sumber: Pixabay. Dandang
Di dalam dandang, stim dihasilkan oleh pemanasan air dan mengekalkan tekanan malar. Kemudian stim ini melakukan pekerjaan yang boleh digunakan, contohnya menjana elektrik dalam tumbuhan thermoelectric atau bertindak mekanisme lain seperti lokomotif dan pam air.
Latihan yang diselesaikan
Latihan 1
Terdapat 40 liter gas pada suhu 27 ° C. Cari peningkatan jumlah apabila menambah haba secara isobárically sehingga mencapai 100 ºC.
Penyelesaian
Undang -undang Charles digunakan untuk menentukan jumlah akhir, tetapi perhatian: suhu mesti dinyatakan di Kelvin, tambah 273 K kepada setiap:
27 ºC = 27 + 273 k = 300 k
100 ºC = 100 + 273 k = 373 k
Dari:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ºC (40 l/300 k) = 49.7 l
Akhirnya kenaikan jumlah adalah v2 - V1 = 49.7 L - 40 L = 9.7 l.
Latihan 2
5 dibekalkan 5.00 x 103 J dari tenaga ke gas yang ideal untuk membuat 2.00 x 103 J kerja di persekitaran anda dalam proses isobaric. Diminta untuk mencari:
a) perubahan tenaga dalaman gas.
b) Perubahan dalam jumlah, jika sekarang tenaga dalaman berkurangan sebanyak 4.50 x 103 J dan 7 diusir.50 x 103 J sistem, memandangkan tekanan berterusan 1.01 x 105 PA.
Penyelesaian kepada
Digunakan Δu = q - w dan nilai -nilai yang diberikan dalam pernyataan itu diganti: Q = 5.00 x 103 J dan W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Oleh itu tenaga dalaman gas meningkat sebanyak 3.00 x 103 J.
Penyelesaian b
Perubahan kelantangan terdapat dalam kerja yang dilakukan: W = pΔv:
Δu = q - w = q - PΔv
Kenyataan itu menegaskan bahawa tenaga dalaman berkurangan, oleh itu: Δu= -4.50 x 103 J. Ia juga memberitahu kita bahawa sejumlah haba diusir: q = -7.50 x 103 J. Dalam kedua -dua kes, tanda negatif mewakili penurunan dan kerugian, maka:
-4.50 x 103 J = -7.50 x 103 J - PΔV
Di mana P = 1.01 x 105 PA. Memandangkan semua unit berada dalam sistem antarabangsa, perubahan dalam jumlah adalah jelas:
Δv = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 PA) = -2.97 x 10-2 m3
Oleh kerana perubahan kelantangan negatif, ini bermakna jumlahnya menurun, iaitu sistem yang dikontrak.
Rujukan
- Byjou. Proses isobaric. Pulih dari: byjus.com.
- Cengel, dan. 2012. Thermodynamics. Edisi ke -7. McGraw Hill.
- Proses XYZ. Ketahui lebih lanjut mengenai proses isobaric. Pulih dari: 10process.X dan z.
- Serway, r., Vulle, c. 2011. Asas Fizik. 9NA ed. Pembelajaran Cengage.
- Wikipedia. Undang -undang gas. Pulih dari: Adakah.Wikipedia.org.
- « 14 Eksperimen psikologi dengan manusia yang sangat kontroversial
- Konsep, jenis dan contoh embullition »

