Proses isokorik
- 4764
- 1516
- Dallas Bernhard
Apakah proses isokorik?
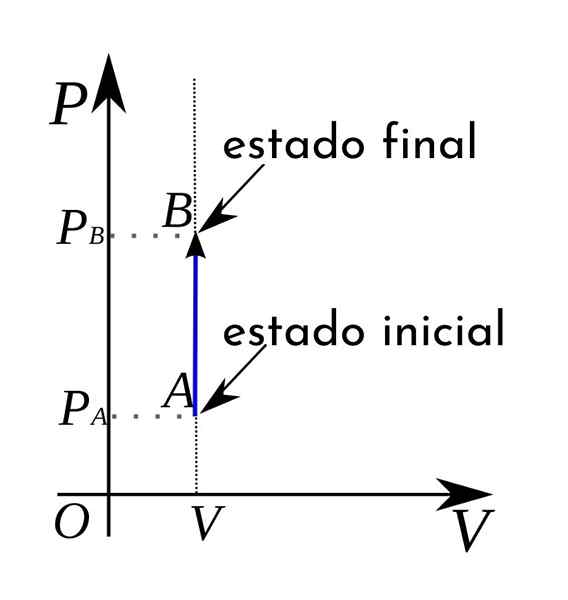
A Proses isokorik Ia adalah proses termodinamik di mana jumlahnya tetap berterusan. Proses ini sering juga menerima nama isometrik atau isovolumetrik. Secara umum, proses termodinamik boleh berlaku pada tekanan malar dan kemudian dipanggil isobaric.
Apabila ia berlaku pada suhu malar, dalam hal ini dikatakan bahawa ia adalah proses isoterma. Sekiranya tidak ada pertukaran haba antara sistem dan persekitaran, maka ada ceramah adiabatik. Sebaliknya, apabila terdapat jumlah yang berterusan, proses yang dihasilkan dipanggil Isocoric.

Dalam hal proses isokorik, dapat disahkan bahawa dalam proses ini, kerja-kerja volume adalah tidak sah, karena hasil ini mengalikan tekanan dengan peningkatan jumlah.
Di samping.
Formula dan pengiraan
Prinsip pertama termodinamik
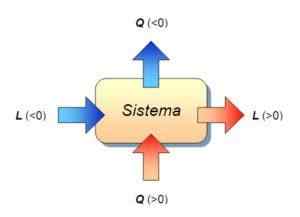
Dalam termodinamik kerja dikira dari ungkapan berikut:
W = p ∙ Δ v
Dalam ungkapan ini w adalah kerja yang diukur dalam joules, p tekanan yang diukur di Newton per meter persegi, dan Δ v ialah variasi atau peningkatan jumlah yang diukur dalam meter padu.
Begitu juga, yang dikenali sebagai prinsip pertama termodinamik menetapkan bahawa:
Δ u = q - w
Dalam formula ini, ia adalah kerja yang dilakukan oleh sistem atau sistem, yang merupakan haba yang diterima atau dikeluarkan oleh sistem, dan Δ u Ia adalah variasi tenaga dalaman sistem. Pada kesempatan ini, tiga magnitud diukur dalam joules.
Oleh kerana dalam proses isocoric, kerja adalah sifar, ternyata ia dipenuhi:
Boleh melayani anda: Neptune (planet)Δ u = qV (Oleh kerana, Δ V = 0, dan oleh itu w = 0)
Iaitu, variasi tenaga dalaman sistem hanya disebabkan oleh pertukaran haba antara sistem dan persekitaran. Dalam kes ini, haba yang dipindahkan dipanggil haba ke jumlah tetap.
 Kapasiti haba pada jumlah tetap
Kapasiti haba pada jumlah tetap
Kapasiti haba badan atau sistem hasil daripada membahagikan jumlah tenaga dalam bentuk haba yang dipindahkan ke badan atau sistem dalam proses tertentu dan perubahan suhu yang dialami oleh yang sama.
Apabila proses dijalankan pada jumlah tetap, ia dibicarakan keupayaan haba kepada jumlah tetap dan dilambangkan oleh cv (kapasiti haba molar).
Ia akan dipenuhi dalam kes itu:
Qv = N ∙ cv ∙ Δt
Dalam keadaan ini, n adalah bilangan tahi lalat, cv Ia adalah molar kapasiti haba yang disebutkan di atas kepada isipadu malar dan Δt adalah peningkatan suhu yang dialami oleh badan atau sistem.
Contoh harian proses isokorik
Adalah mudah untuk membayangkan proses isokorik, hanya perlu memikirkan proses yang berlaku pada jumlah yang berterusan; iaitu, di mana bekas yang mengandungi sistem bahan atau bahan tidak berubah jumlahnya.
Contohnya boleh berlaku (ideal) terkunci dalam bekas tertutup yang jumlahnya tidak dapat diubah dengan cara yang dibekalkan. Katakan kes gas terkunci dalam botol.
Dengan memindahkan haba ke gas, seperti yang telah dijelaskan, ia akan mengakibatkan peningkatan atau peningkatan tenaga dalamannya.
Proses terbalik adalah gas yang tertutup dalam bekas yang jumlahnya tidak dapat diubah suai. Jika gas sejuk dan memberi haba kepada alam sekitar, maka tekanan gas dan nilai tenaga dalaman gas akan berkurangan akan dikurangkan.
Ia boleh melayani anda: Pembolehubah Diskret: Ciri dan ContohOtto kitaran yang ideal
Kitaran Otto adalah kes ideal kitaran yang digunakan oleh mesin petrol. Walau bagaimanapun, penggunaan awalnya berada di mesin yang menggunakan gas asli atau bahan api lain dalam keadaan gas.
Walau apa pun, kitaran ideal Otto adalah contoh yang menarik dari proses isokorik. Ia berlaku apabila di dalam kereta pembakaran dalaman, pembakaran petrol dan campuran udara berlaku dengan serta -merta.
Dalam hal ini, peningkatan tekanan suhu dan gas dalam silinder berlaku, baki jumlah tetap.
Contoh praktikal
Contoh pertama
Memandangkan gas (ideal) terkunci dalam silinder yang disediakan dengan omboh, tunjukkan sama ada kes -kes berikut adalah contoh proses isokorik.
- 500 j kerja pada gas selesai.
Dalam kes ini, ia tidak akan menjadi proses isokorik kerana melakukan pekerjaan di atas gas yang diperlukan untuk memampatkannya, dan oleh itu, mengubah jumlahnya.
- Gas mengembang secara mendatar omboh.
Sekali lagi ia tidak akan menjadi proses isokorik, kerana pengembangan gas menyiratkan variasi dalam jumlahnya.
- Omboh silinder ditetapkan supaya gas tidak dapat dipindahkan dan gas disejukkan.
Pada kesempatan ini ia akan menjadi proses isokorik, kerana tidak akan ada variasi kelantangan.
Contoh kedua
Tentukan variasi tenaga dalaman yang akan mengalami gas yang terkandung dalam bekas dengan jumlah 10 L yang dikemukakan kepada 1 atm tekanan, jika suhunya meningkat dari 34 ºC hingga 60 ° C dalam proses isokorik, diketahui haba haba tertentu Cv = 2.5 ·R (menjadi R = 8.31 J/mol · k).
Ia boleh melayani anda: Graff Van Generator: Pihak, Bagaimana Ia Berfungsi, AplikasiOleh kerana ia adalah proses kelantangan yang tetap, variasi tenaga dalaman hanya akan berlaku akibat haba yang dibekalkan kepada gas. Ini ditentukan dengan formula berikut:
Qv = N ∙ cv ∙ Δt
Untuk mengira haba yang dibekalkan, pertama kali perlu untuk mengira tahi lalat gas yang terkandung di dalam bekas. Untuk ini, adalah perlu untuk menggunakan persamaan gas ideal:
P ∙ v = n ∙ r ∙ t
Dalam persamaan ini n adalah bilangan tahi lalat, r adalah malar yang nilainya adalah 8.31 j/mol · k, t ialah suhu, p ialah tekanan yang diukur gas di atmosfera dan t tertakluk dan t adalah suhu yang diukur di Kelvin.
Ia dibersihkan dan diperoleh:
n = r ∙ t/ (p ∙ v) = 0, 39 mol
Jadi itu:
Δ u = qV = N ∙ cv ∙ Δt = 0.39 ∙ 2.5 ∙ 8.31 ∙ 26 = 210.65 j

